Тип 3: Вычисление массы или объема продукта реакции по известной массе и объему исходного вещества, содержащего примесь.
При решении задач этого типа необходимо объяснить учащимся, что расчеты ведутся только по чистому веществу, содержание которого надо первоначально вычислить. Над формулой вещества в уравнении пишется масса (объем) чистого вещества.
Примесью может быть и вода раствора.
Задача: Железо массой 12.2 г сплавили с серой массой 6.4 г. К полученному продукту добавили избыток соляной кислоты. Выделившийся газ пропустили через раствор массой 200 г, с массовой долей CuCl2 15%. Какая масса осадка образовалась, если его выход составил 80%?
| Дано: | |
| m(Fe) = 12.2 г | |
| m(S) = 6.4 г | |
| mр-ра (CuCl2) = 200 г | |
| w (CuCl2) = 15% | |
| h = 80% | |
| m(CuS) = ? |
Решение:
12.2 г 6.4 г
1) FeS + S = FeS
1моль 1 моль 1 моль
изб. недост.
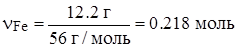
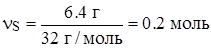
n(FeS) = n(S) = 0.2 моль.
0.2 моль
2) FeS + 2HCl = FeCl2 + H2S
1 моль 1 моль
n(FeS) = n(H2S) = 0.2 моль.
3) Прежде, чем вести расчеты по следующему уравнению, найдем массу чистого вещества хлорида меди:
m(CuCl2) = mр-ра · w m(CuCl2) = 200 г · 0.15 = 30 г
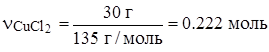 (избыток)
(избыток)
0.222 моль 0.2 моль
CuCl2 + H2S = CuS¯ + 2HCl
1моль 1 моль 1 моль
M=135 г/моль M=96 г/моль
изб. недост.
n(CuS) = n(H2S) = 0.2 моль
mтеор.(CuS) = 0.2 моль · 96 г/моль = 19.2 г.
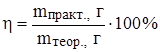
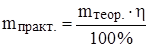 mпракт.(CuS) = 19.2 г · 0.8 = 15.36 г.
mпракт.(CuS) = 19.2 г · 0.8 = 15.36 г.
Дата добавления: 2015-08-21; просмотров: 2631;
