Тип 1: Нахождение молекулярной формулы органического вещества на основании его плотности и массовых долей элементов (процентного состава).
Задача: Хлоропроизводное предельного углеводорода имеет плотность по водороду, равную 118.5.
Массовые доли элементов в этом соединении следующие: Cl ‑ 89.9%; C - 10.1%. Найти молекулярную формулу данного соединения.
| Дано: | |
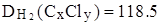
| |
| w(Cl) = 89.9% | |
| w(C) = 10.1% | |
| CxCly = ? |
Решение:
Находим Mr (необходимо помнить, что без знания Mr установить точную формулу нельзя):
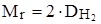 Mr = 2 · 118.5 = 237.
Mr = 2 · 118.5 = 237.
Существуют два способа дальнейшего решения задачи.
Способ 1 решения (наиболее простой): на основании математической формулы массовой доли элемента.
С исходными математическими формулами учащиеся знакомы еще с 8 класса (ранее был выделен данный тип задач, сейчас – нет).
Если вещество CxCly, его относительная молекулярная масса известна, то
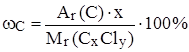 ,
, 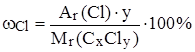 ,
,
из чего следует:
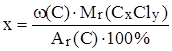 ,
, 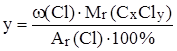 ,
,
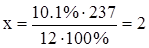 ,
, 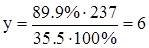 .
.
Ответ: Молекулярная формула соединения – C2Cl6.
Способ 2 решения задачи используется чаще всего, если не известна Mr. Он заключается в нахождении первоначально соотношения числа (N) атомов элементов, образующих молекулу.
Исходим из тех же математических формул для x и y:
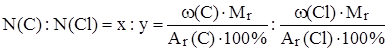 ,
,
после преобразований получаем:
 ,
, 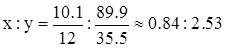 .
.
Следует объяснить учащимся, что число атомов может быть только целым, поэтому надо разделить большее число на меньшее:
x : y = 1 : 3.
Таким образом, простейшая формула соединения CCl3. Сравним Mr данной молекулы с Mr, вычисленной на основании 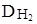 .
.
Mr(CCl3) = 12 + 3 · 35.5 = 118.5,
что в два раза меньше, чем вычислено по 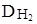 , то есть формула соединения (CCl3)2 или C2H6.
, то есть формула соединения (CCl3)2 или C2H6.
Первый способ, если известна относительная молекулярная масса, является более предпочтительным.
Дата добавления: 2015-08-21; просмотров: 2269;
