I. ОСНОВЫ МОЛЕКУЛЯРНОЙ СТАТИСТИКИ 1 страница
ПРЕДИСЛОВИЕ
Молекулярная физика преподается студентам физических специальностей как курс современной физики, демонстрирующий возможности двух универсальных методов исследования окружающего мира: термодинамического и статистического. В настоящее время эти методы находят широкое применение не только в различных областях физики, но также в химии, биологии, медицине и даже в сфере гуманитарных знаний.
Несмотря на то, что центр тяжести в преподавании дисциплины смещен в сторону изучения методов описания макросистем, вопросы, касающиеся особенностей молекулярных форм движения, также рассматриваются и раскрываются достаточно полно. Обсуждение многочисленных результатов экспериментальных исследований молекулярных систем занимает заметный объем курса в соответствии со сложившимися традициями преподавания общей физики и способствует не только высокому уровню освоения знаний, но и развитию умений применения законов физики для решения конкретных теоретических и практических задач.
Среди различных форм обучения в университете, лекция по-прежнему продолжает оставаться «горячей точкой опоры». Ее главная цель – формирование прочной базы для последующего усвоения студентами учебного материала в процессе самостоятельной работы и аудиторных практических занятий.
В основе книги лежит курс лекций по молекулярной физике, который в течение многих лет читался автором для студентов физических специальностей Красноярского государственного университета, а затем Сибирского федерального университета. Данная версия теоретического курса соответствует современным представлениям модульного обучения и состоит из трех частей (модулей). Каждая часть представляет собой автономную, но в то же время взаимосвязанную с другими модульную программу.
Содержание каждого модуля отражено в названиях:
1. Основы молекулярной статистики.
2. Основы термодинамики.
3. Физика реальных макросистем.
Последовательность изучения модулей согласно их нумерации является предпочтительной, хотя первые два модуля можно менять местами. При таком подходе требуется ввести небольшой поправочный элемент в модуль 2. Разумеется, что лекция «Предмет молекулярной физики и её методы» в любом варианте остается первой, являясь по своей сути введением в дисциплину.
По окончании самостоятельной работы с учебным материалом каждой лекции предусматривается проведение выходного контроля приобретенных знаний и умений студентом в предметной области лекции.
I. ОСНОВЫ МОЛЕКУЛЯРНОЙ СТАТИСТИКИ
ЛЕКЦИЯ 1
ПРЕДМЕТ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ЕЕ МЕТОДЫ
1.1. Предмет молекулярной физики
Весь окружающий нас мир заполнен материальными телами, в том числе и нашими собственными, состоящими из огромного числа молекул. Это макросистемы или молекулярные системы. Предмет молекулярной физики – МОЛЕКУЛЯРНЫЕ ФОРМЫ ДВИЖЕНИЯ, т.е. движения больших совокупностей молекул. Когда мы говорим «большие» совокупности молекул, то имеем в виду не 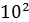 ,
, 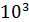 частиц, а
частиц, а 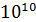 ,
, 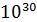 и более…!
и более…!
Например, в каждом кубическом сантиметре пространства аудитории содержится 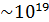 молекул воздуха. Молекула в широком смысле – это структурный элемент материальной системы. Молекула в узком смысле – это наименьшая частица вещества, обладающая всеми его химическими свойствами.
молекул воздуха. Молекула в широком смысле – это структурный элемент материальной системы. Молекула в узком смысле – это наименьшая частица вещества, обладающая всеми его химическими свойствами.
В рамках нашей дисциплины в качестве молекул, как правило, будем рассматривать объекты микромира:
• Элементарные частицы (электроны, фотоны);
• Ядра атомов и нуклоны;
• Атомы и ионы;
• Молекулы (в узком смысле);
• Квазичастицы (фононы).
Термин «движение» в молекулярной физике трактуется не только как механическое движение, но и как изменение (сохранение) состояния макросистемы, её развитие и превращение. Последовательность изменений называется процессом. Например, при нагревании тел могут происходить самые разнообразные изменения их состояний: возрастание температуры и давления газа, заключенного в сосуд или кипение и испарение жидкости или изменение кристаллической структуры твердых сред.
Атомно-молекулярная структура макроскопических тел, это надежно обоснованный экспериментальный факт. К прямым методам наблюдения молекул относятся методы современной микроскопии и рентгеноструктурный анализ. Последним достижением в микроскопии является создание в 80-е годы прошлого века туннельного микроскопа. Использование сканирующего туннельного микроскопа позволяет получать информацию о распределении электронной плотности на поверхности образца и с помощью компьютера воспроизводить изображение внутренней структуры исследуемого вещества. Кроме прямых экспериментов, позволяющих наблюдать молекулы, существует множество косвенных, анализ которых дает информацию о размерах молекул, параметрах их движения и характере межмолекулярных взаимодействий. Например, широкое применение находят данные спектроскопии в оптическом и радиоволновом диапазонах.
1.2. Масштабы физических величин в молекулярном мире
Пока не будем касаться масштабов величин в мире элементарных частиц и прочей экзотики. Рассмотрим обычные атомы и молекулы. Самый малый и самый распространенный во Вселенной атом, атом водорода, имеет размер  . Эту величину надо обязательно запомнить! С ней мы будем сравнивать все другие пространственные размеры и расстояния. Ясно, что другие атомы имеют несколько большие размеры, а именно до
. Эту величину надо обязательно запомнить! С ней мы будем сравнивать все другие пространственные размеры и расстояния. Ясно, что другие атомы имеют несколько большие размеры, а именно до  м (атом урана). Размеры молекул изменяются в более широких пределах
м (атом урана). Размеры молекул изменяются в более широких пределах 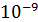 ÷
÷ 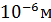 . Кстати, 1 нанометр =
. Кстати, 1 нанометр = 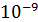 м, а с приставки НАНО начинается название новой, бурно развивающейся науки нанотехнологии.
м, а с приставки НАНО начинается название новой, бурно развивающейся науки нанотехнологии.
Использование методик, основанных на манипуляциях с отдельными атомами и молекулами, позволяет создавать устройства, имеющие размеры 1÷ 100 нм. В настоящее время это направление является наиболее перспективным для получения новых материалов, полупроводниковых приборов, устройств для записи информации, фармацевтических препаратов и многого другого.
Вернемся к масштабам. Массы атомов по порядку величины заключены в пределах от 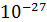 кг (атом водорода) до
кг (атом водорода) до 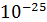 кг (атом урана). Массы молекул имеют значения от 10-27кг (молекула водорода) до
кг (атом урана). Массы молекул имеют значения от 10-27кг (молекула водорода) до 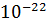 кг (крупные белковые молекулы).
кг (крупные белковые молекулы).
Количество частиц в макросистемах столь велико, что его удобно измерять в особых единицах – молях. Моль это количество вещества, содержащее число структурных элементов, равное постоянной Авогадро:
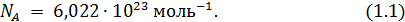
В молях можно измерять количества любых структурных элементов. Например, если в некотором сосуде содержится 1 моль молекул кислорода 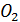 , то там имеется 2 моль атомов кислорода, или 16 моль протонов, 16 моль нейтронов и 16 моль электронов.
, то там имеется 2 моль атомов кислорода, или 16 моль протонов, 16 моль нейтронов и 16 моль электронов.
Молю соответствует масса, её называют молярной массой µ, для различных веществ она разная, поскольку массы их молекул 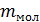 отличаются друг от друга
отличаются друг от друга

Молярная масса выражается в кг/моль. Её можно рассчитать для каждого вещества на основе его химической формулы, используя массовые числа из таблицы Менделеева. Зная 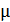 и массу вещества
и массу вещества 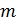 легко найти количество молей его молекул.
легко найти количество молей его молекул.

Представление о масштабах времени в молекулярных системах можно получить хотя бы из того факта, что при нормальных условиях в воздухе каждая молекула газа за 1 с испытывает около 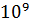 столкновений с другими частицами. Такая яркая, насыщенная событиями жизнь. Ведь при каждом столкновении, происходящем в среднем через
столкновений с другими частицами. Такая яркая, насыщенная событиями жизнь. Ведь при каждом столкновении, происходящем в среднем через 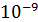 с, меняется скорость и энергия молекулы, изменяется ее состояние. Наблюдая макросистемы, мы, как правило, измеряем длительность происходящих в них макропроцессов в интервале 10-6÷105с.
с, меняется скорость и энергия молекулы, изменяется ее состояние. Наблюдая макросистемы, мы, как правило, измеряем длительность происходящих в них макропроцессов в интервале 10-6÷105с.
1.3. Теоретические и экспериментальные методы молекулярной физики
Дискретная структура вещества не вызывает сомнений, но для теоретического описания макросистем во многих случаях оказывается полезным представление о веществе как о сплошной среде. Такое представление материи называется макроскопическим в отличие от молекулярного, микроскопического. Его правомерность основана на том, что размеры молекул и расстояния между ними много меньше размеров макроскопических тел. Вещество как непрерывный континуум характеризуется плотностью 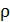 . Для однородных тел
. Для однородных тел

где 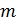 и
и 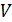 – масса и объем тела соответственно.
– масса и объем тела соответственно.
Анализ возможностей изучения систем многих частиц показал, что динамическое описание таких систем «неосуществимо с технической, не пригодно с теоретической и бесполезно с практической точек зрения» [11]. Поэтому поиск теоретических подходов шел в направлении использования информации, имеющей обобщенный характер, т.е. относящейся ко всей системе в целом. В результате были разработаны два радикально отличающихся друг от друга метода исследования макросистем: статистический и термодинамический. Эти методы имеют и другие названия, которые приведены ниже на схеме 1.3.1. Следует иметь в виду, что зачастую молекулярной физикой называют только статистическую физику, точнее её основы, например, в названии учебника «Термодинамика и молекулярная физика» [14].
Далее в 1.5 мы дадим развернутые характеристики статистического и термодинамического подходов в описании макросистем и сформулируем их задачи.
Говоря об экспериментальных методах молекулярной физики отметим, что они чрезвычайно разнообразны. Действительно, изучение структурных, электрических, магнитных, тепловых и механических свойств макросистем требует совершенно разных измерительных инструментов и методов. Их разнообразие обязано также специфике свойств разных агрегатных состояний вещества. Газ, жидкость, твердое тело, плазма – это по сути объекты относительно самостоятельных научных направлений, каждое из которых имеет развитую экспериментальную базу (физика твердого тела, физика плазмы и т.д.).
Схема 1.3.1.
| Методы изучения макросистем |
Статистический
 микроскопический
микроскопический
 молекулярно-кинетический
молекулярно-кинетический
|
Термодинамический
 макроскопический
макроскопический
 феноменологический
феноменологический
|
Дисциплина «Молекулярная физика» основывается на обобщении многочисленных результатов экспериментальных исследований в этих разных областях. Поэтому вам следует приготовиться к накоплению знаний о реальных макросистемах, необходимых для практической деятельности и для дальнейшего изучения дисциплин естественнонаучного цикла. Главная цель, которая ставится перед вами, заключается в освоении методов изучения макросистем. Заявив о наших целях, необходимо уточнить предметную область дисциплины, определенную в 1.1.
1.4. Эволюция молекулярных систем. Порядок и хаос
Начнем с исходного понятия системы. Рассмотрим два не противоречащих друг другу, но все-таки разных подхода.
Понятие 1. Система – (от греч. systema – целое, составленное из частей, соединение), множество элементов, находящихся в отношениях и связях друг с другом, которое образует определенную целостность, единство.
Системы подразделяют на простые,содержащие небольшое количество элементов, и сложные,содержащие большое количество элементов и связей между ними. По умолчанию в своих предшествующих рассуждениях мы придерживались именно этого представления, понимая под молекулярными системами сложные системы.
Понятие 2. Система – конечная область пространства с находящимися в ней физическими объектами исследования.
В первом рассмотренном нами понятии акцент сделан на структурных свойствах системы. Во втором – внимание заостряется на границе пространственной области, занимаемой системой. Граница может быть как материальной (стенка сосуда), так и воображаемой, проведенной в пространстве мысленно. Она может быть проницаемой или непроницаемой для вещества, через нее возможен или невозможен обмен энергией с другими телами. Классификация систем на этой основе приведена на схеме 1.4.1.
| Системы |
| Изолированные или замкнутые (нет обмена ни веществом, ни энергией) |
| Неизолированные |
| Закрытые (обмен только энергией) |
| Открытые (обмен энергией и веществом) |
Для дальнейшего рассмотрения учебного материала необходимо дать определение такому основополагающему понятию, как термодинамическое равновесие. Изменения в молекулярных системах можно описать с помощью микроскопических и макроскопических параметров. Микроскопические параметры характеризуют состояния отдельных молекул. Примером могут быть их скорости, энергии, магнитные моменты. Макроскопические параметры характеризуют состояние системы в целом, например, температура, давление, плотность вещества.
Термодинамическое равновесие – это стационарное состояние изолированной системы, в котором ее макроскопические параметры сохраняют свои постоянные значения во времени и во всех точках пространства, занимаемого системой.
В этом состоянии нет градиентов температуры, плотности и других макропараметров. В определении равновесного состояния требование изолированности системы существенно. Если система не изолирована, то возможно стационарное состояние, которое не является равновесным.
Перспективы развития системы зависят от условий ее нахождения относительно равновесного состояния. Например, для биологической системы термодинамическое равновесие – это смерть. Обратимся к схеме 1.4.2, представляющей различные варианты эволюции молекулярных систем. Предметная область нашей дисциплины ограничивается левым полем схемы 1.4.2 (в равновесии и вблизи термодинамического равновесия) за исключением некоторых вопросов физики атмосферы Земли.
Дисциплины, изучающие свойства молекулярных систем в различных условиях приведены на схеме 1.4.3.
Схема 1.4.2.
| Самопроизвольная эволюция связана с дезорганизацией и беспорядком. Хаос достигает своего максимального значения. Состояние изолированной системы, полученное таким путем, соответствует термодинамическому равновесию. Нарушение изоляции системы со «слабым» обменом энергией или веществом приводит к хорошо предсказуемым процессам. |
| Открытые |
| Сложная эволюция. Возможна самоорганизация – возникновение упорядоченных структур. Множественность траекторий развития. Примеры: химические соединения, астрофизические объекты, биологические системы. |
| Замкнутые |
| Молекулярные системы |
| Вблизи термодинамического равновесия равновесия |
| Диссипативные структуры |
| Далеко от термодинамического равновесия |
Схема 1.4.3.
| ● Статистическая физика ● Термодинамика |
| ● Статистическая теория ● Неравновесная термодинамика ● Синергетика |
| Далеко от термодинамического равновесия |
| Вблизи термодинамического равновесия |
| Дисциплины, изучающие свойства молекулярных систем |
В качестве примера самоорганизации в физической системе рассмотрим процесс теплопередачи в пластинках Рэлея-Бенара. Это стеклянные пластинки, между которыми заключен тонкий слой вязкой жидкости. В зависимости от условий в них возможны различные механизмы теплопередачи, которые представлены на схеме 1.4.4.
Схема 1.4.4.
| Далеко от термодинамического равновесия |
 Теплота
∆T ≥ ∆Tкр
Самоорганизация – коллективное круговое движение жидкости. Образование структуры в виде регулярных «валов». Конвективный механизм теплопередачи.
Теплота
∆T ≥ ∆Tкр
Самоорганизация – коллективное круговое движение жидкости. Образование структуры в виде регулярных «валов». Конвективный механизм теплопередачи.
|
 Теплота
∆T < ∆Tкр
Механизм теплопередачи в жидкости – теплопроводность или тепловая диффузия. Хаос с «эстафетным» механизмом передачи энергии от молекулы к молекуле, от слоя к слою.
Теплота
∆T < ∆Tкр
Механизм теплопередачи в жидкости – теплопроводность или тепловая диффузия. Хаос с «эстафетным» механизмом передачи энергии от молекулы к молекуле, от слоя к слою.
|
| Вблизи термодинамического равновесия |
| Теплопередача в пластинках Рэлея-Бенара |
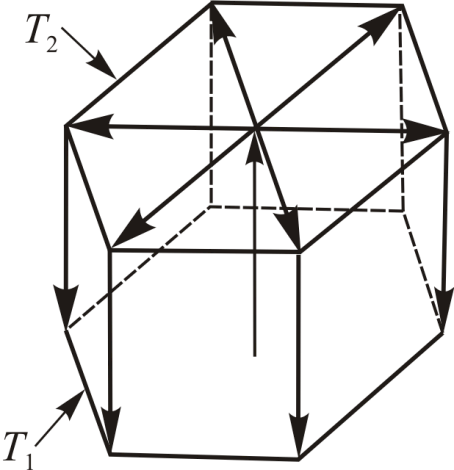 Рис. 1.1.
Рис. 1.1.
|
Другой пример самоорганизации – ячейки Бенара.
В слое силиконового масла, открытого сверху и подогреваемого снизу, при условии ∆T>∆Tкр образуются шестиугольные ячейки Бенара (рис. 1.1).
Конвективный поток тепла поднимается вертикально вверх вдоль оси ячейки. Затем равномерно растекается от центра к периферии верхней грани и далее по боковым граням вниз к горячей подложке. Весь слой масла становится самоорганизованной структурой из плотно прилегающих друг к другу боковыми гранями подобных ячеек. Размеры ячеек могут достигать десятков миллиметров. Приведенные примеры демонстрируют, что неравновесность может быть источником порядка. Подобные метаморфозы изучает синергетика.
1.5. Принципы организации статистического и термодинамического методов изучения макросистем
Термодинамика возникла в первой половине XIX века как теоретическая основа теплотехники. Ее первоначальная задача сводилась к изучению закономерностей и условий оптимизации превращения теплоты в работу в паровых машинах. В дальнейшем термодинамика вышла далеко за пределы технической задачи. Центр тяжести переместился в сторону изучения физических явлений в макросистемах. Это произошло во второй половине XIX века.
В это же время появились пионерские работы по молекулярному движению Максвелла. Свое развитие молекулярно-кинетическая теория получила в работах Больцмана. Концепция атомизма в XIX веке подвергалась резкой критике и нападкам многочисленных оппонентов. Непримиримая идеологическая борьба развернулась в европейском научном сообществе. В качестве противников учения Больцмана на конгрессах и съездах выступали такие известные ученые как Й. Лошмидт, Э. Мах, В. Оствальд, Ж. Пуанкаре, М. Планк. Тем не менее, идеи статистического подхода физики макросистем были подхвачены учеными в разных частях света.
Свое дальнейшее развитие термодинамический и статистический методы получили в ХХ веке. Большой вклад в развитие молекулярной физики внесли выдающиеся российские ученые: Д.И. Менделеев, А.Г. Столетов, М.П. Авенариус, Т.А. Афанасьева-Эренфест, Н.Н. Боголюбов, П.Л. Капица, Л.Д. Ландау, М.А. Леонтович и другие. В настоящее время термодинамический и статистический методы являются универсальными методами теоретического исследования сложных систем и находят широкое применение не только в различных областях физики, но также в химии, биологии, медицине, т.е. во всем естествознании.
Статистический метод
В системах многих частиц проявляются особые закономерности, не свойственные отдельным молекулам. Их возникновение обусловлено чрезвычайной массовостью случайных и неконтролируемых факторов, действующих в макросистемах. Такие закономерности называются вероятностными или статистическими. Открытие законов нового типа, в которых все связи между физическими величинами носят вероятностный характер, является основной задачей теории.
В основе статистического метода лежит модель материального тела, или атомная гипотеза. Моделью материального тела называется большая совокупность частиц, свойства которых, законы движения и взаимодействия известны.
Модели используются как готовые «продукты», полученные из других областей науки: структурной химии, квантовой физики, квантовой химии, физики твердого тела и т.д. Молекулы (объекты микромира), как правило, подчиняются законам квантовой физики, однако, при определенных условиях они ведут себя как объекты классической механики.
Выбор модели, это всегда беспокойный процесс угадывания, требующий от исследователя обращения, как к рациональному, так и интуитивному уровням познания. Желательно, чтобы модель была не слишком сложной и в тоже время отражала существенные свойства конкретной реальной системы.
Область применимости модели задается интервалом температур, давлений или характерными размерами сосуда (трубки, отверстия) и тщательно анализируется на основе априорных теоретических представлений. Окончательная проверка адекватности модели осуществляется путем сравнения полученных на ее основе результатов с экспериментальными данными. Для статистического описания макросистем используется математический аппарат теории вероятностей и математической статистики. Ядро статистической теории содержит комплекс понятий и положений, а также два постулата. Основные законы молекулярной статистики представлены в виде распределений вероятностей состояний системы. Во многих случаях эти законы имеют универсальный характер, независимо от вида модели материального тела. Задача молекулярной статистики формулируется как трехуровневая или триединая:
1. Обоснование применимости тех или иных статистических законов для описания молекулярных форм движения.
2. Вычисление средних значений микроскопических параметров системы.
3. Установление связей между средними микроскопическими параметрами системы и ее макроскопическими характеристиками.
Термодинамический метод
Как уже отмечалось в 1.3, систему многих частиц можно исследовать, не интересуясь ее внутренней структурой. В этом случае модель материального тела не имеет смысла. Макросистема рассматривается как сплошная среда с плотностью 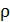 . Для описания используются физические величины, относящиеся к системе в целом – макроскопические параметры, которые могут быть измерены экспериментально.
. Для описания используются физические величины, относящиеся к системе в целом – макроскопические параметры, которые могут быть измерены экспериментально.
Макроскопические параметры условно подразделяют на внешние и внутренние.Внешними параметрами называются такие, значения которых определяются положением тел, не входящих в изучаемую макросистему. К ним относятся занимаемый системой объем 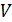 и напряженности внешних силовых полей
и напряженности внешних силовых полей 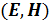 . Внутренними параметрами называются параметры, определяемые совокупным движением и распределением в пространстве входящих в систему частиц. К ним относятся давление
. Внутренними параметрами называются параметры, определяемые совокупным движением и распределением в пространстве входящих в систему частиц. К ним относятся давление 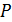 , температура
, температура 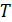 , магнитный момент системы
, магнитный момент системы 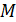 и многие другие.
и многие другие.
Уравнение, выражающее функциональную связь между внутренними и внешними макроскопическими параметрами в состоянии термодинамического равновесия, называется обобщенным уравнением состояния системы.
Важнейшими исходными понятиями термодинамики являются внутренняя энергия системы, макроскопическая работа и теплота. Физическая природа теплоты не рассматривается. Термодинамика является аксиоматической наукой. Фундамент теории образуют четыре постулата, или принципа. В российской научной традиции их принято называть началами термодинамики.
Индивидуальность системы, ее специфика отражается в двух уравнениях, которые используются при решении конкретных задач. Это термическое уравнение состояния 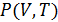 и калорическое уравнение состояния, отражающее зависимость внутренней энергии системы от ее температуры и объема
и калорическое уравнение состояния, отражающее зависимость внутренней энергии системы от ее температуры и объема 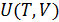 . Подобного рода уравнения «компенсируют» отсутствие модели материального тела. Они могут быть получены эмпирически, как результат огромного числа измерений или взяты из статистической теории.
. Подобного рода уравнения «компенсируют» отсутствие модели материального тела. Они могут быть получены эмпирически, как результат огромного числа измерений или взяты из статистической теории.
Постулаты позволяют получать многочисленные соотношения между различными макроскопическими параметрами в аналитической форме. Макроскопические свойства системы могут быть полностью описаны на основе этих уравнений и экспериментальных данных о теплоемкостях. Таким образом, задачей термодинамики является полное описание макросистемы на полуэмпирической основе.
В заключение отметим, что, несмотря на идеологические расхождения и драматические отношения между творцами термодинамического и статистического методов молекулярной физики в пору её становления, в наши дни оба подхода взаимно дополняют друг друга. Их комплексное применение способствует эффективному решению научных задач.
Контрольные вопросы.
1. Что является предметом молекулярной физики?
Конкретизируйте предметную область изучаемой дисциплины.
2. Какие методы позволяют наблюдать молекулярную структуру макроскопических тел?
3. Назовите характерные размеры атомов и молекул.
4. Дайте определение единицы измерения 1 моль. Что можно измерять в молях?
5. Какие теоретические методы разработаны для изучения макросистем?
6. В чем заключается особенность экспериментальных методов молекулярной физики?
7. Разъясните смысл двух имеющихся понятий системы. Перечислите основные виды систем.
8. Какие параметры называются микроскопическими и макроскопическими?
9. Дайте определение термодинамического равновесия.
10. Каковы характерные особенности эволюции сложных систем вблизи и в удаленности от термодинамического равновесия? Какие дисциплины изучают молекулярные системы в разных условиях?
11. При каких условиях образуются ячейки Бенара? Что это такое?
12. В чем заключаются принципиальные отличия статистического и термодинамического методов изучения макросистем?
ЛЕКЦИЯ 2
МОДЕЛИ МОЛЕКУЛЯРНЫХ СИСТЕМ И ИХ ВЕРОЯТНОСНОЕ ОПИСАНИЕ
2.1. Классификация моделей молекулярных систем
В основе статистического подхода к описанию молекулярных явлений, как уже отмечалось, лежит модель материального тела. Обратимся к типологии моделей молекулярных систем, отраженной на схеме 2.1.1.
Схема 2.1.1.
| Модели молекулярных систем |
| Классификация |
| Системы |
| Идеальные – структурные элементы почти не взаимодействуют между собой. |
| Неидеальные – структурные элементы взаимодействуют между собой. |
Классические
Проекции координат и импульсов всех молекул ( 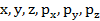 ), описывающие их поступательные, вращательные и колебательные движения. ), описывающие их поступательные, вращательные и колебательные движения.
|
Квантовые
Набор квантовых чисел ( 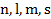 ,…), определяющий энергетические состояния частиц. Характерным признаком для выражения энергии квантовых систем является h – постоянная Планка. ,…), определяющий энергетические состояния частиц. Характерным признаком для выражения энергии квантовых систем является h – постоянная Планка.
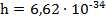 
|
| Степени свободы – число независимых переменных, которыми определяется состояние системы. |
| Независимые переменные |
| Непрерывные переменные. |
| Дискретные переменные |
Дата добавления: 2015-08-11; просмотров: 2829;
