Распределение молекул по скоростям и энергиям. Барометрическая формула
Молекулы газа движутся с различными по величине и направлению скоростями. Возникает вопрос: как распределены молекулы по скоростям? Ответ на этот вопрос дал выдающийся английский физик Джеймс Клерк Максвелл в 1859 году. В дальнейшем это распределение стали называть "распределением Максвелла".
Для краткости рассмотрим молекулы одного сорта, каждая из которых обладает массой т. Будем полагать, что все направления движения молекул в пространстве равновероятны. Очевидно, что молекул, обладающих нулевой скоростью, практически нет; также нет и молекул, обладающих бесконечно большой скоростью (с учетом эффектов теории относительности скорости молекул не могут быть равны или превышать с = 3 • 108м/с). Чтобы ответить на поставленный выше вопрос, нам нужно знать, какое количество молекул попадает в заданный интервал скоростей. Попробуем разобраться в этом вопросе.
Пусть общее количество молекул, содержащихся в сосуде — N. Тогда обозначим через dN количество молекул, скорости которых заключены в интервале от v до v + dv. Отношение dN/dv называется плотностью распределения молекул по скоростям. Функция f(v) — dN/(Ndv) называется функцией распределения молекул по скоростям или функцией распределения Максвелла. При этом также полагают, что газ находится в равновесном состоянии, т.е. температура и давление газа во всех частях сосуда одинаковы. Функция f(v) дает нам плотность вероятности того, что данная молекула обладает скоростью v. Очевидно, что
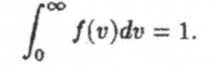
Это означает, что какой-то скоростью в интервале [0, ∞] молекула обязательно обладает. Вообще же, вероятность того, что скорость молекулы лежит в интервале [v,v + dv], задается соотношением dp = f(v)dv. Как показал Максвелл, функция распределения имеет вид
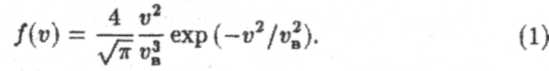
Здесь vв = 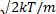 , к= 1,38 • 10-23Дж/К — постоянная Больцмана, Т — абсолютная температура газа. График функции распределения показан на рисунке 1.
, к= 1,38 • 10-23Дж/К — постоянная Больцмана, Т — абсолютная температура газа. График функции распределения показан на рисунке 1.
Максимуму кривой распределения соответствует скорость vв, называемая наиболее вероятной скоростью. Ее значение легко определяется, если производную от функции (1) приравнять к нулю. Тогда можно убедиться, что эта производная 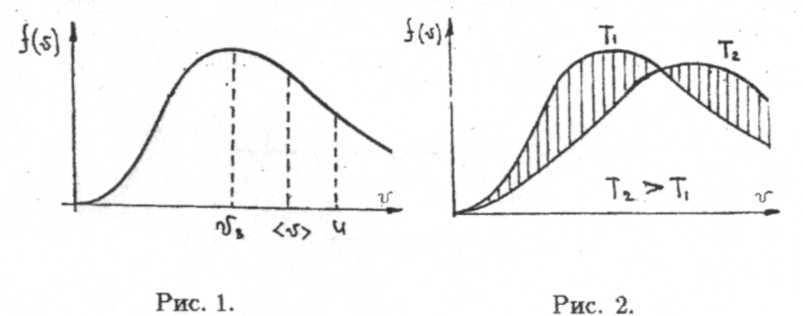 обращается в нуль при v = t>„; причем, экстремум, имеющий место в этой точке, соответствует максимуму функции распределения. Две другие характерные скорости (v) — средняя арифметическая и u — средняя квадратичная находятся из соотношений
обращается в нуль при v = t>„; причем, экстремум, имеющий место в этой точке, соответствует максимуму функции распределения. Две другие характерные скорости (v) — средняя арифметическая и u — средняя квадратичная находятся из соотношений
Здесь μ — молярная масса газа, т — масса молекулы газа, R — универсальная газовая постоянная. Заметим, что с ростом температуры T максимум функции распределения смещается вправо вдоль оси v. При этом площадь под кривой распределения в силу определения функции f(v) не изменяется.
На рисунке 2 качественно показаны две кривые распределения при различных температурах. Заштрихованные площади на рисунке 2 должны быть одинаковы.
Дата добавления: 2015-08-11; просмотров: 1011;
