Связь между давлением и температурой газа
Объединяя уравнение Клаузиуса (5) и Больцмана (6), получим:

Из уравнения (7) определим постоянную Лошмидта (Nl),т.е. число молекул в единице объема газа при нормальных условиях:
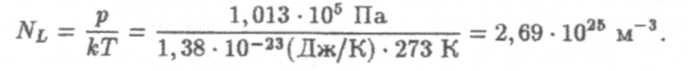
По постоянной Лопшидта можно получить число Авогадро:
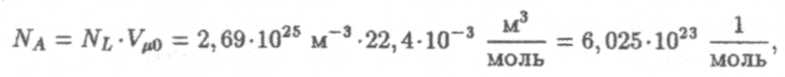
где Vμ0 — объем моля газа при нормальных условиях.
Уравнения (5), (7) являются основными уравнениями молекулярно-кинетической теории газа. Из них можно теоретически вывести (как следствия) все экспериментальные газовые законы (к чему мы и переходим).
Вывод экспериментальных газовых законов из молекулярно-кинетической теории газа
а) Вывод уравнения Клапейрона-Менделеева (уравнения состояния идеального газа).
В уравнение (7) введем п = N/V, учитывая, что N/NA = т/μ, где N — число молекул в объеме газа, т и μ — масса и молярная масса газа. Тогда получим:
— уравнение Клапейрона-Менделеева для любой массы газа, где R = kNa молярная газовая постоянная. Для одного моля газа уравнение (8) имеет вид:

где Vμ — объем моля газа. Из уравнения (9) вычислим R, зная что при нормальных условиях (T = 273 К, р = 1,013 • 105 Па) молярный объем равен 22,4 • 10-3 м3/моль; для газовой постоянной R имеем:
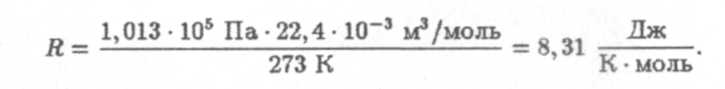
Тогда определится и постоянная Больцмана;

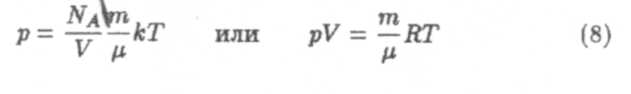
б) Вывод закона Клапейрона. Из уравнения (9) запишем:

Обозначим (m/μ)R — В, тогда:

— закон Клапейрона. В отличие от R, В не универсальна, а своя для каждого газа из-за различия молярной массы.
в) Вывод закона Бойля-Мариотта (для изотермического
 процесса). Согласно формуле (9) и учитывая, что для данной массы газа: т = const; μ = const; Т = const, имеем:
процесса). Согласно формуле (9) и учитывая, что для данной массы газа: т = const; μ = const; Т = const, имеем:
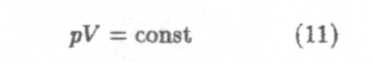
— закон Войля-Мариотта.
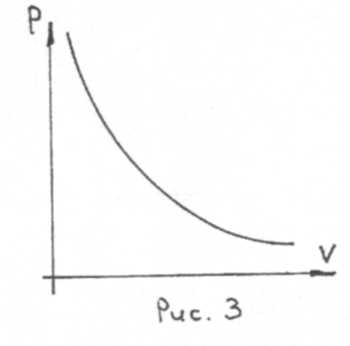
Для данной массы газа произведение давления на объем при постоянной температуре остается постоянным.
Очевидно, что график изотермического процесса представляется равнобочной гиперболой (рис. 3).
г) Вывод закона Гей-Люссака (для изобарического процесса). Напишем уравнение (8) для двух состояний газа при постоянном давлении — для любого и нормального состояний:
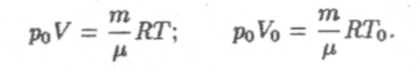
Поделив первое уравнение на второе, получим:

—закон Гей-Люссака.
При изобарическом процессе объем газа пропорционален его термодинамической температуре.
Этот закон можно представить и в другой форме:
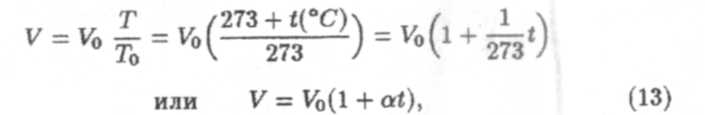
где а = 1/273 К-1 — коэффициент объемного расширения газа.
Для данной массы газа объем газа при постоянном давлении изменяется линейно с температурой.
Графиком закона является наклонная линия, исходящая из ОК (-273вС) (рис.4).

д) Вывод закона Шарля (для изохорического процесса). Напишем уравнение (9) при V = const и т = const для любого и нормального состояний
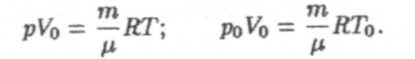
Поделив первое уравнение на второе, получим:

—закон Шарля.
При изохорическом процессе давление газа пропорционально его термодинамической температуре.
Закону можно также придать вид:

где τ — термический коэффициент давления (7 = 1/273 К-1).
Для данной массы газа при постоянном давлении объем газа изменяется линейно с температурой.
График данного закона изображен на рис. 5.

е) Вывод закона Дальтона. Пусть в некотором объеме содержится несколько различных газов. Давление смеси — р. Удалим из объема все газы, кроме первого. Тогда он займет весь объем и будет иметь давление p1, называемое парциальным давлением первого газа (part — часть).
Парциальным давлением газа, входящего в газовую смесь, называется давление, которое имел бы этот газ, если бы он один занимал весь объем, предоставленный смеси.
Аналогично определим парциальное давление всех остальных газов смеси: р1, р2, р3,...рi<. Обозначив п и пi соответственно объемные концентрации молекул смеси газов и i-го газа, запишем:
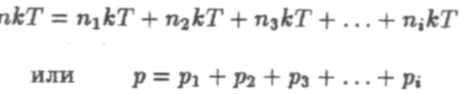
— закон Дальтона.
Давление газовой смеси равно сумме парциальных давлений входящих в нее газов.
Закон был установлен экспериментально в 1801 году английским физико-химиком Дальтоном.
Вывод закона Авогадро. Из уравнения (3) молекулярно-кинетической теории получим pV = NkT. Но для одного моля газа V = Vμ и N = Na (Na — постоянная Авогадро) запишем:

Так как Na и к —постоянные величины, то из последнего равенства следует закон Авогадро установленный им в 1811 году:
При одинаковой температуре и давлении моли любых газов занимают одинаковые объемы.
При нормальных условиях, т.е. при р = 1,013 • 105 Па и Т = 273,16 К, этот объем составляет 0,0224 м3/моль.
Лекция № 11
Дата добавления: 2015-08-11; просмотров: 4224;
