Билет 26
1). Биметаллические комплексы платиновых металлов[M(SnX3)5]3-, M=Pd(II), Pt(II): [M(SnX3)5X]n-, M = Rh(III), Ir(III), Ru(II), Os(II): X = Cl-, Br-, I- являются устойчивымитолько в сильно кислых средах. При снижении кислотностирастворов M-Sn комплексы с указанными лигандами под-вергаются гидролизу. При этом ацидолиганды (Cl-, Br-, I-) в координационной сфере атомов олова(II) полностью замещаются на гидроксид-ионы. В результате образуются малорастворимые гидролизованные формы, в которых связи MSn сохраняются. Высокая склонность M-Sn комплексовк гидролизу обусловлена тем, что в результате образованияM-Sn связей происходит значительный перенос заряда с атомов Sn(II) на металл. Эффективный положительный заряд на атомах Sn(II) при этом существенно возрастает, и оловосодержащие лиганды приобретают свойства жёстких кислот Льюиса, которые проявляют большое сродство к жестким основаниям, таким, как гидроксид-ионы. Из этого следует, что М-Sn комплексы с кислородсодержащими ацидолигандами у атомов Sn(II), т.е. с жесткими основаниями, должны подвергаться гидролизу в меньшей степени, чем MSn комплексы с лигандами SnX31- (X = Cl, Br, I). Установлено, что M-Sn комплексы не подвергаются гидролизу только в тех случаях, когда ацидолиганды, содержащие электронодонорные атомы кислорода, образуют с атомами Sn(II) замкнутые циклические группировки. К таким ацидолигандам следует отнести анионы карбоновых окси-кислот: лимонной, винной, яблочной. Путь к получению устойчивых растворов M-Sn комплексов в слабокислых, нейтральных или щелочных средах определяется выбором ацидолигандов с электронодонорными атомами кислорода или азота, способных образовывать высоко устойчивые 5-6-членные циклы с атомами Sn(II), которые будут блокировать доступ гидроксид-ионов в координационную сферу атомов Sn(II) и предотвращать гидролиз M-Sn комплексов. Кроме анионов оксикислот такую роль могут выполнять этилендиаминтетраацетат-ионы (ЭДТА4-).Высоко устойчивые комплексы олова(II) с ионами ЭДТА4-известны.Интерес к получению устойчивых растворов M-Sn комплексов в менее кислых и тем более в нейтральных и щелочных средах обусловлен открывающимися в этом случае возможностями для изучения реакций замещения в MSn комплексах с участием таких лигандов, как амины, фосфины, и многие др., которые в кислых средах протонируются и выступают в качестве катионов. Сильнокислые среды ограничивают возможности применения M-Sn комплексов в процессах, связанных с извлечением, разделением и концентрированием платиновых металлов, а также в процессах сорбции и экстракции. Для изучения электрохимических свойств M-Sn комплексов необходим широкий диапазон рН растворов, не ограниченный только кислыми средами. В работе изучено комплексообразование Pd(II) с Sn(II) в растворах с pH=4,7 (ацетатный буфер) при мольном соотношении ЭДТА4-:Sn(II) = 1. Установлено, что в таких условиях образуются Pd(II)-Sn комплексы, которые характеризуются интенсивной полосой в электронных спектрах поглощения (ЭСП) с λmax=290 нм, низким изомерным сдвигом на атомах олова и высоким квадрупольным расщеплением в ядерно γ-резо-нансных (ЯГР) спектрах. Однако растворы Pd(II)-Sn комплексов при соотношениях ЭДТА4-:Sn(II) = 1 оказались неустойчивыми. После нагревания растворов (1000C) параметры оптических и ЯГР спектров Pd(II)-Sn комплексов изменяются. Полоса поглощения от 290 нм смещается к 255 нм, изомерный сдвиг увеличивается, квадрупольное расщепление возрастает. Такие изменения в спектрах авторы связывают с образованием Pd-Sn комплексов с более низкой степенью окисления палладия.





2).Амальгамы — так называются соединения (сплавы) ртути с другими металлами; отсюда — амальгамировать, соединять со ртутью, покрывать (с поверхности) металлические предметы ртутью.
Оксид ртути построен из плоских зигзагообразных цепей, образованных линейными фрагментами О—Hg—О, повернутыми друг относительно друга на угол 107° . Он существует в виде двух форм: красной и желтой, не являющихся полиморфными модификациями, но различающихся лишь размером частиц. Красный оксид ртути получают прокаливанием металла на воздухе или в токе кислорода при 350 °С, а желтый осаждают из растворов солей
действием щелочи. Если осаждение вести из горячих растворов, вьщеляется оранжевый осадок с частицами более крупного размера по сравнению с красной формой оксида. В отличие от ZnO и CdO оксид ртути термически неустой-чив и при нагревании выше 4Q0 "С разлагается на ртуть и кислород. Оксид практически не растворим в воде и не
взаимодействуюет с ней, но реагирует с кислотами с образованием солей. оксид ртути(2) с растворами щелочей не взаимодействует.
Соли ртути(2) подобно соединениям цинка и кадмия бесцветны, но в отличие от них в водных растворах сильно гидролизованы:
[Hg(H20)6]2+ à [Hg(H20)5(OH)]+ + H+
Соли ртути(2) известны преимущественно с сильными кислородсодержащими кислотами. В растворах они сильно гидролизованы, многие лишь частично диссоциированы. При нагревании все они разлагаются до оксида, а выше 400 °С — и до металла. Среди солей ртути(П) в лабораторной практике часто используют нитрат Hg(N03)*2H20, кристаллизующийся из растворов, полученных растворением ртути в избытке концентрированной азотной кислоты.
Действием на нитрат ртути(2) нитритом калия выделяют нитритный комплекс K3[Hg(N02)4]N03, в котором атом ртути координирован восемью атомами кислорода четырех нитритных групп, расположенными в вершинах архимедовой антипризмы. Комплекс состава K2[Hg(N02)4] получают по реакции обмена между сулемой HgCl2 и нитритом серебра с последующим добавлением избытка нитрита калия. Известен гексанитромеркуратртути(2)-рубидия Rb2Hg[Hg(N02)6] . Средний нитрит ртути(И) известен, но неустойчив. Сульфат HgS04 получают растворением ртути или ее оксида в концентрированной серной кислоте. Из растворов в разбавленной серной кислоте кристаллизуется моногидрат HgS04•Н20, в котором атом ртути находится в октаэдрическом окружении из атома кислорода молекулы воды и пяти атомов кислорода мостиковых сульфатных групп. Дальнейшее разбавление раствора приводит к выпадению осадка основной соли, которая при слабом нагревании превращается в оксосоль, а далее разлагается на оксид и металл. В безводной соли атом ртути находится в сильноискаженном тетраэдре из четырех атомов кислорода. Основная соль Hg3(OH)2(S04)2(H20) содержит загзагообразные цепи [О3SO—Hg(µ2-OH)Hg(µ2-OH)Hg— OS03]. Оксосульфат Hg302(S04) содержит слои, в которых каждый атом кислорода связывает три атома ртути, занимающие вершины треугольника. Средние соли слабых кислот: угольной, кремниевой и сернистой — мало устойчивы или вообще неизвестны. Так, действие карбонатов и гидрокарбонатов на растворы солей ртути приводит к образованию оксида HgO или осадка основных солей переменного состава, которые со временем превращаются в оксид или оксокарбонат Hg302(C03). Сульфит HgS03, выделяющийся в виде белого осадка при действии сульфитов на соли ртути(2), также быстро разлагается. Более устойчива комплексная соль Na2[Hg(S03)2], в которой сульфитные группы координируют ртуть атомами серы. Известно несколько фосфатов ртути(2): Hg3(P04)2, HgHP04, Hg2P207.
Соли ртути(2), главным образом карбоксилаты, хорошо растворимые не только в воде, но и в органических растворителях, широко используют в качестве катализаторов в реакциях гидратации и алкоксилирования. Процесс
протекает через стадии меркурирования, т.е. образования ртутьорганического соединения, и последующего его гидролиза.
В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ со связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании: 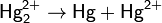
подщелачивании: 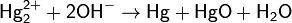
добавлении лигандов, стабилизирующих степень окисления ртути +2.
3). Метод валентных связей (МВС)можно рассматривать как современное развитие теории Льюиса, в соответствии с которой два атома совместно владеют одной или несколькими парами электронов. Согласно МВС связь образуется при перекрывании электронных орбиталей двух атомов и объединении двух электронов — возникает двухэлектронная,
двухцентровая связь (2е, 2с). Известны два механизма образования такой связи: либо оба атома предоставляют в общее пользование по одному электрону, ЛИбО ОДИН аТОМ {донор) Предоставляет пару электронов, а другой (акцептор) — пустую орбиталь (донорно-акцепторНЫЙ Механизм). Результат ОДИН И ТОТ Же: две орбитали перекрываются, и на них находятся два электрона. Например, в ионе аммония три связи Н—N образованы перекрыванием одноэлектронных облаков, а четвертая — по донорно-акцепторному механизму. В результате все 4 связи не различимы и равноценны. В МВС ковалентная связь характеризуется насыщаемостью, поляризуемостью и направленностью.
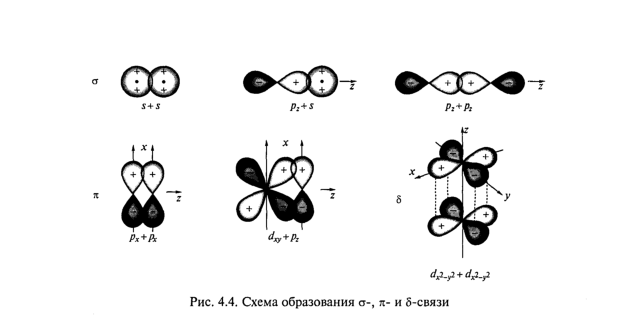
В зависимости от симметрии орбиталей, образующих связь, различают σ, π и δ-связи. Схема образования таких связей приведена на рис. 4.4. Орбитали, образующие σ-связь, имеют цилиндрическую симметрию относительно линии, соединяющей ядра. Такая связь может образоваться при перекрывании s-, р-, d- f-орбиталей. Для орбиталей, образующих π-связь, линия, соединяющая ядра, является осью симметрии 2-го порядка, и при этом происходит
инверсия знака волновой функции (при повороте орбитали на 180° изменяется только знак волновой функции). Такой вид связи получается при перекрывании р- и d-орбиталей. Наиболее редкий вид связи — δ-связь образуется при
перекрывании d-орбиталей, которые симметричны относительно плоскости, проходящей перпендикулярно линии, соединяющей ядра.
Прочность связи. В рамках МВС прочность связи определяется степенью перекрывания орбиталей, σ-связь всегда прочнее π-связи, а кратная связь (двойная: σ- и π-, тройная: σ- и 2π-) всегда прочнее одинарной
(σ-). Прочность связей, как правило, уменьшается с ростом радиуса атома. Например, в ряду молекул Н20, H2S, H2Se, H2Te с ростом радиуса центрального атома Э (О, S, Se, Те) прочность связи Э—Н уменьшается.
Полярность связи. Если связь образована двумя одинаковыми атомами, то электроны в равной степени принадлежат обоим атомам и молекула неполярноя. В том случае, когда связь образована двумя разными атомами, электронная
плотность смещена в сторону более электроотрицательного атома. Такая связь называется полярной. При увеличении разности электроотрицательностей атомов, образующих связь, эффективный заряд увеличивается, и в предельном случае можно считать, что электроны полностью переходят к более электроотрицательному атому. Предельным случаем полярной ковалентной связи является ионная связь.
Направленность связи. Геометрия молекулы определяется взаимным расположением в пространстве орбиталей атома, образующих химическую связь. Поскольку связь возникает при перекрывании атомных орбиталей, а они строго
направлены в пространстве, то ковал ентные связи имеют вполне фиксированое направление, которое определяется максимальной степенью перекрывания орбиталей. Для геометрии молекулы важным является только положение
σ-связи. Например, молекула сероводорода H2S — нелинейная, так как связь образована двумя p-орбиталями серы, находящимися под углом 90. Однако в некоторых случаях возникает несоответствие между реальной геометрией молекулы и предполагаемым направлением орбиталей в пространстве. Для устранения возникшего противоречия в методе валентных связей введено понятие гибридизации. Гибридизация — смешение орбиталей по энергии и форм.
Билет.
Дата добавления: 2015-08-11; просмотров: 922;
