БИЛЕТ 18.
1. Общая характеристика. Сера, селен, теллур Э.
Сера, селен, теллур – состав 16й группы, халькогены (от греч рождающие медные руды). В природе чаще всего встречаются в форме соединений меди: сульфидов, селенидов и т.п.
В основном состоянии атомы имеют электронную конфигурацию ns2np4 с четным числом валентных электронов, два из которых неспарены. При переходе от серы к теллуру размер атомов и их возможные координационные числа увеличиваются, а значения энергии ионизации и электроотрицательность – уменьшаются. Сера типичный неметалл, селен и теллур металлоиды с характерными металлическими свойствами.
Проявляют высшую степень окисления +6. Устойчивость Э+6 понижается от серы к теллуру. Окислительная способность селена в высшей степени окисления значительно выше, чем у теллура и серы. Объяснение этого явления обусловлена влиянием внутренней 4f электронной оболочки, электроны которых слабо экранируют заряд ядер атомов. (т.е. происходит сжатие электронных оболочек из за повышения заряда ядра).
Для серы, селена и теллура образование двух одинарных связей оказывается предпочтительнее, чем одной двойной. При переходе от кислорода к сере прочность одинарной σ - связи растет из-за ослабления межэлектронного отталкивания, а прочность π – связи понижается, что связано с ростом радиуса и уменьшением перекрывания атомных p – орбиталей по π – типу.
Способность атомов элементов соединяться в кольца или цепи называется катенацией. Наиболее характерна катенация для серы, селена и теллура: для них известны цепи, содержащие десятки и сотни тысяч атомов. Катенация характерна не только для простых веществ. Известны соединения, содержащие гомоатомные цепи и циклы, стабилизированные концевыми атомами –H, -Cl или группами –SO3-
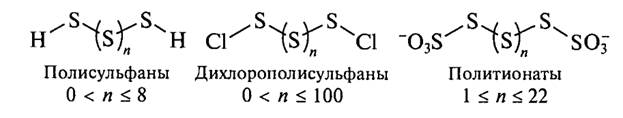
В свойствах серы прослеживается больше аналогий с селеном и теллуром. Так, в соединениях с отрицательными степенями окисления от серы к теллуру усиливаются восстановительные, а в соединениях с положительными степенями окисления – окислительные свойства, наиболее сильно выраженные у селена.
Химические и физические свойства.
Сера.
Ромбическая S(ромб.) и моноклинная S(мон.) модификации серы построены из циклических молекул S8, размещенных по узлам ромбической и моноклинной кристаллических решеток. Ромбическая сера желтого(tпл=112,8), а моноклинная сера бледно-желтого цвета(tпл=119,3). Малоустойчивая в обычных условиях пластическая сера состоит из нерегулярно расположенных зигзагообразных цепочек S∞. При t=200 сера становится темно-коричневой и вязкой, как смола происходит разрушение кольцевых молекул S8 и образование длинных цепей S∞. Дальнейшее нагревание выше 250оС ведет разрыву цепей, и жидкость снова становится более подвижной. При 444,6 сера закипает, в зависимости от температуры в парах образуются молекулы S8, S6, S4 и S2. При 1500 молекулы S2 диспропорционируют на атомы. Молекулы S2 парамагнитны, во всех других состояниях сера диамагнитна.
В воде сера практически нерастворима; некоторые ее модификации растворяются в органических жидкостях и в особенности в сероуглероде. Сера – достаточно активный неметалл. Даже при умеренном нагревании она окисляет многие простые вещества, но и сама довольно легко окисляется кислородом и галогенами. При нагревании в кипящих растворах щелочей сера диспропорционирует:
3S + 6NaOH = 2Na2SO3 + 3H2O
Селен.
Как и сера, селен имеет полиморфные модификации. Наиболее устойчив гексагональный или серый селен. Его кристаллы образованы зигзагообразными цепями Se∞. При быстром охлаждении жидкого селена получается красно-коричневая стекловидная модификация. Она образована неупорядоченно расположенными молекулами Se∞ разной длины. Кристаллические разновидности красного селена состоят из циклических молекул Se8, подобных S8. Серый селен – полупроводник.
Теллур.
У теллура устойчива гексагональная модификация. Это серебристо-белое металлоподобное кристаллическое вещество. Однако он хрупок, легко растирается в порошок. Его электрическая проводимость незначительна, но при освещении увеличивается, т.е. теллур – полупроводник. Аморфный теллур менее устойчив, чем аморфный селен, и при 25 С переходит в кристаллический.
Селен и теллур с водой и разбавленными кислотами не реагирует. Подобно другим неметаллам, окисляются концентрированной HNO3 до кислот. При кипячении в щелочных растворах Se и Te, подобно S, диспропорционируют:
3Э + 6NaOH = 2Na2ЭO3 + 2K2Э + 3H2O
При нагревании селен и теллур довольно легко окисляются кислородом и галогенами, при сплавлении взаимодействуют с металлами.
Нахождение в природе. Получение.
Халькогены в природе сконцентрированы в рудных месторождениях, где они связаны преимущественно с металлами. Значительная часть серы находится либо в самородном состоянии (вулканическая сера), либо в форме сульфидов и сульфатов. Из природных газов, содержащих сероводород, серу получают путем окисления части H2S до сернистого газа и взаимодействия образовавшегося SO2 с H2S в присутствии катализаторов на основе оксидо железа и алюминия:
2H2S+SO2=3S↓+2H2O
Основным источником селена и теллура служат остатки после электролитической очистки меди, содержащие также значительное количество серебра, золота и платиновых металлов, отходы сернокислотного и целлюлозо – бумажного производства, некоторые свинцово – цинковые и висмутовые руды. В них оба элемента содержатся в форме халькогенидов.
Теллур осаждается в виде гидратированного диоксида, а селенистая кислота осаждается в растворе. Из этого раствора действием SO2 осаждают красный селен чистотой 99,5%:
H2SeO3+2SO2+H2O=Se↓+2H2SO4
Гидратированный TeO2 растворяют в щелочи и электролитически восстанавливают до теллура:
Na2TeO3+H2O  Te↓+ 2NaOH+O2↑
Te↓+ 2NaOH+O2↑
Окислительно-восстановительные свойства соединений Э.
Водородные соединения.
В водных растворах гидриды H2Э ведут себя как слабые двухосновные кислоты. Сила кислот возрастает от серы к теллуру благодаря понижению энергии связи Э-H и обеспечению ее разрыва при политропическом взаимодействии с водой:
H2Э + H2О = H3О+ + HЭ-
Халькогеноводороды сгорают на воздухе с образованием диоксидов:
H2Э + 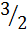 О2 = ЭО2 + H2О
О2 = ЭО2 + H2О
Но при недостатке окислителя могут быть получены и простые вещества.
В кислых растворах H2Э ведут себя как мягкие восстановители. Восстановительные свойства H2Э усиливаются при переходе от H2O к H2Po. Кислород, галогены и другие типичные окислители(HNO3, KMnO4, KClO3) окисляют халькогеноводороды. Сероводород в зависимости от условий может окисляться в водном растворе до серы, сернистого газа, тиосульфата, политионатов, серной кислоты:
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
H2S + I2 = 2HI + S↓
Сульфиниды, селениды и теллуриды металлов.
Встречаются в природе как минералы и руды и служат сырьем для получения металлов.
В воде хорошо растворимы лишь сульфиды щелочных металлов, аммония и бария. Их водные растворы вследствие гидролиза имеют щелочную реакцию.
2CaS + 2H2O = Ca(HS)2 + Ca(OH)2↓
Процессы получения многих металлов сводятся к переработке их сульфидов металлов, например MS, с кислородом в зависимости от условий теоритически возможно образование оксидов:
2MS(тв.) + 3O2 = 2MO(тв.) + 2SO2↑,
Сульфатов:
MS(тв.) + 2O2 = MSO4(тв.),
Или металлов:
MS(тв.) + O2 = M(тв.) + SO2↑.
Галогениды халькогенов.
Галогениды S, Se – жидкости и газы, кроме тв. SeCl4
Гигроскопичны, кроме SF6
SeCl4+ 3H2O = H2SeO3+ 4HCl гидролиз
SF6+ 6HI = 6HF + 3I2+ S
Галогениды теллура – твердые вещества, кроме TeF6
Бромиды и иодиды не реагируют с водой при н.у.
TeBr4+ H2O ≠
TeCl4+ 3H2O = TeO2·H2O + 4HCl
Оксиды халькогенов.
С увеличением размера атома халькогена в ряду SeO2—ТеO2—РоO2 ослабевают кислотные и, наоборот, усиливаются основные свойства. Твердый диоксид селена хорошо растворим в воде, и при этом образуется селенистая кислота:
SeO2 + Н2O = H2SeO3
Оксиды ТеO2 в воде не растворяется в силу высокой энергии
кристаллической решетки. Диоксид теллура, подобно сернистому и селенистому ангидриду, взаимодействует со щелочами, образуя теллуриты металлов:
ТеO2 + 2NaOH = Na2TeO3 + H2O
В то же время он, проявляя амфотерные свойства, реагирует с кислотами-
окислителями:
2ТеO2+ HNO3 = Te2O3(OH)NO3
а за счет комплексообразования — и с соляной кислотой:
ТеO2 + 6HC1 = Н2ТеС16 + 2Н2O
Для диоксидов серы, селена и теллура характерна окислительно-восстановительная двойственность. Восстановительные свойства наиболее выражены у SO2 и ТеO2. Так, сернистый газ обесцвечивает йодную воду:
SO2 + I2 + 2Н2O = 2HI + H2SO4
и раствор перманганата калия:
5SO2 + 2КMnO4 + 2H2O = 2MnSO4 + 2KHSO4 + H2SO4
Окислительные свойства S02 проявляются при взаимодействии с сильными восстановителями:
SO2 + 2СО = S + 2СO2 (при 5000С, Al2O3)
SO2 + 2H2 =S + 2H2O
Серный ангидрид – одно из самых реакционноспособных соединений. Он проявляет окислительные свойства, например, превращает уголь в углекислый газ:
2SO3 + С = 2SO2 + СO2
Особенности взаимодействия SO3 с галогенводородами связаны с ростом
восстановительных свойств в ряду НС1—HBr— HI. Окислительные свойства SO3 усиливаются с ростом температуры. При слабом нагревании SO3 реагирует с газообразным НС1, образуя хлорсульфоновую кислоту HSO3C1:
SO3 + НС1 = HO(Cl)SO2
При повышении температуры НСl восстанавливает SО3 до SО2 с одновременным образованием Сl2. При действии на НВг триоксида серы при 0°С выделяются SО2 и свободный бром:
2SО3 + 2HBr = SО2 + Br2 + H2SО4
Йодистым водородом SО3 восстанавливается до H2S даже при охлаждении ниже 0°С:
SO3 + 8HI = H2S + 4I2 + 3H2O
Селеновый ангидрид - сильнейший окислитель. Он окисляет хлороводород до хлора:
SeO3 + 2HC1 = H2SeO3 + Cl2
а фосфор — до фосфорного ангидрида:
5SeO3 + 2Р = Р2O5 + 5SeO2
Окислительные свойства триоксида теллура выражены гораздо слабее, чем Se03, -он вытесняет хлор из соляной кислоты только при нагревании.
Оксокислоты халькогенов Э(IV).
Сернистая кислота H2S03 в индивидуальном состоянии не выделена. Селенистая кислота H2Se03 — белое кристаллическое вещество, хорошо растворимое в воде. Ее получают окислением селена разбавленной HN03:
3Se + 4HN03 + Н20 = 3H2Se03 + 4NO
Теллуристая кислота — это гидратированный диоксид Те02 • хН20. Она образуется в виде белого осадка при гидролизе тетрагалогенидов:
ТеС14 + (2 + х)Н20 = Те02 • хН20↓ + 4HC1
Сила кислот уменьшается в ряду H2S03—H2Se03—Н2Те03. По мере роста радиуса и уменьшения электроотрицательности атом халькогена слабее смещает электронную плотность от атома кислорода гидроксильной группы и, таким образом, слабее поляризует связь О—Н.
Усиление окислительной способности:
H2SO3 > H2TeO3> H2SeO3
Оксокислоты халькогенов(VI)
В молекуле H2S04 сера тетраэдрически окружена четырьмя атомами кислорода, два из которых входят в состав гидроксильных групп. Длины связей в молекуле H2S04 таковы, что связи S—О можно считать двойными, а связи S—ОН - одинарными. Бесцветные, похожие на лед кристаллы H2S04 имеют слоистую структуру: каждая молекула H2S04 соединена с четырьмя соседними молекулами прочными водородными связями, образуя единый пространственный каркас.
H2S04 и H2Se04 — сильные двухосновные кислоты. Они близки по структуре и свойствам. Их соли — сульфаты и селенаты — изоморфны и образуют квасцы состава МАl(Э04)3* 12Н20, где М — щелочной металл; Э = S, Se.
Ортотеллуровая кислота Н6Те06 — бесцветное гигроскопичное вещество, хорошо растворимое в воде. Ее структура отличается от структуры H2S04 и H2Se04 и построена из правильных октаэдров Те06, сохраняющихся и в растворах. Такое строение обусловливает отличие свойств Н6Те06 от свойств H2S04 и H2Se04. Отсутствие концевых атомов кислорода, которые могли бы оттягивать электронную плотность от атома Те и поляризовать связь Н—О, объясняет тот факт, что Н6Те06 слабее даже угольной кислоты.
Усиление окислительной способности:
H2SO4 > H6TeO6> H2SeO4
Соединения серы: сероводород, сульфиды, сульфаны, полисульфиды, оксид серы(IV), сернистая кислота, сульфиты.
Кислоту H2S04 можно называть ортосерной кислотой, так как в ней содержится наибольшее число гидроксильных групп, связанных с одним атомом серы(VI). При дегидратации H2S04 или при насыщении водного раствора серной кислоты серным ангидридом:
H2S04 + S03 = H2S207
Пиросерная кислота — бесцветные прозрачные кристаллы (tпл= 35 °С), дымящие на воздухе. Ее соли — пиросульфаты — получают обезвоживанием кислых сульфатов.
Серная и селеновая кислота.
В молекуле H2S04 сера тетраэдрически окружена четырьмя атомами кислорода, два из которых входят в состав гидроксильных групп. Длины связей в молекуле H2S04 таковы, что связи S—О можно считать двойными, а связи S—ОН - одинарными. Бесцветные, похожие на лед кристаллы H2S04 имеют слоистую структуру: каждая молекула H2S04 соединена с четырьмя соседними молекулами прочными водородными связями, образуя единый пространственный каркас. При температуре 10,3°С H2S04 плавится с образованием тяжелой маслянистой жидкости, кипящей с разложением при 300 "С. Такая кислота дымит на воздухе. Структура жидкой H2S04 такая же, как твердой, только целостность пространственного каркаса нарушена, и его можно представить как совокупность микрокристалликов, постоянно меняющих свою форму.
Серная кислота обладает сильными окислительными свойствами только в концентрированном растворе и при нагревании:
2H2S04(конц.) + Си = CuS04 + S02 + 2Н20
Серная кислота смешивается с водой в любых соотношениях, процесс сопровождается образованием различных гидратов H2S04*nН20.
Теплота гидратации настолько велика (приблизительно 880 кДж/моль), что смесь может даже вскипеть, разбрызгаться и вызвать ожоги кожи и разрушение одежды. Поэтому необходимо добавлять кислоту к воде, а не наоборот, поскольку при добавлении Н20 в H2S04 более легкая вода окажется на поверхности кислоты, где и сосредоточится вся выделяющаяся теплота. В результате может произойти вскипание и разбрызгивание. Высокое сродство серной кислоты к воде позволяет использовать ее как водоотнимающее средство.
С серной кислотой реагируют многие простые вещества — металлы и неметаллы. На холоде H2S04 инертна по отношению к таким металлам, как железо, алюминий и даже барий. Продуктами ее восстановления в зависимости от условий проведения реакций (природы металла, температуры, концентрации) могут быть S02, H2S, S, политионаты.
Серная кислота образует два ряда солей: сульфаты и гидросульфаты. Гидросульфаты некоторых переходных и постпереходных металлов представляют собой комплексные кислоты. Термическая устойчивость сульфатов определяется природой катиона, а состав продуктов разложения зависит от температуры процесса.
Безводная H2Se04 — бесцветное неустойчивое кристаллическое вещество, построенное из слоев искаженных тетраэдров Se04 и плавящееся при 57 °С с разложением:
2H2Se04 = 2H2Se03 + 02
2. Соединения никеля(III), кобальта(III) и железа(III). Получение. Сравнение устойчивости и окислительно-восстановительных свойств.
Оксиды.
Оксид Fe203. Оксид железа(III) встречается в природе в виде минерала
гематита со структурой корунда, представляющей собой плотнейшую гексагональную упаковку из ионов кислорода, в октаэдрических пустотах которой находятся ионы железа. Гематит образуется при дегидратации оксогидроксида железа(Ш), разложении железного купороса при температуре 700 — 800 "С.
Оксид железа(Ш), полученный при низкотемпературном обезвоживании гидроксида, растворим в кислотах с образованием растворов солей железа(Ш), при сплавлении реагирует с щелочами и карбонатами с образованием ферритов:
Fe203 + Na2C03 = 2NaFe02 + C02
Существование оксида кобальта(Ш) точно не установлено, хотя в пользу его образования свидетельствует способность Со304 поглощать кислород. По-видимому, формулу Со203 можно условно приписать бурому порошку, образующемуся при осторожном обезвоживании оксогидроксида кобальта(III) или при термическом разложении [Co(NH3)3(N02)3]. Содержание кислорода в полученном продукте всегда оказывается меньше стехиометрического, что свидетельствует о наличии в нем хотя бы небольшой части ионов Со2+. Оксид никеля(III) как индивидуальное вещество неизвестен.
Гидроксиды.
Гидроксид железа(III) относят к слабым (Kb ~10-11) амфотерным основаниям с преобладающими основными свойствами. Он легко растворим в кислотах с образованием растворов солей железа(Ш); с концентрированными растворами щелочей при рН > 14 дает бесцветные гидроксоферраты(III):
3Ва(ОН)2 + 2FeOOH + 2Н20 = Ba3[Fe(OH)6]2
Гидроксид железа(III) в водных растворах устойчив как к окислению, так и к восстановлению. Сильные окислители (бром, гипохлорит) способны перевести его в ферраты(V1).
В степени окисления +3 железо образует соли практически со всеми кислотами. Сульфат железа(III) кристаллизуется из водных растворов в виде различных гидратов, содержащих до десяти молекул воды. Подобно многим другим солям трехзарядных катионов сульфат железа(Ш) образует квасцы KFe(S04)2*12H20, кристаллизующиеся в форме красивых бледно-фиолетовых октаэдров. Нитрат железа(Ш) проще всего получать взаимодействием железа с 50%-й азотной кислотой. Соль кристаллизуется в виде бледно-лиловых кристаллов, представляющих собой нонагидрат. При слабом нагревании она плавится в своей кристаллизационной воде, а при температуре 125 °С расплав закипает с разложением.
Ион Fe3+ является слабым окислителем. Он вступает в реакции лишь с сильными восстановителями, такими как сероводород, соли олова(II), гидразин, гидроксиламин, иодид:
2FeCl3 + S02 + 2H20 = 2FeCl2 + H2S04 + 2HC1
Для железа(III), как и для изоэлектронного ему марганца(II), характерно образование высокоспиновых октаэдрических комплексов, обсуждавшихся ранее на примере акваиона.
Аммиакаты железа(Ш), например [Fe(NH3)6]Br3, образующийся при взаимодействии твердого безводного бромида железа(Ш) с газообразным NH3, существуют только в неводных средах, поэтому для осаждения гидроксида железа(Ш) удобно использовать водный раствор аммиака.
Низкоспиновые комплексы железа(III) известны лишь с лигандами сильного поля. Все они рассмотрены при описании свойств соединений железа(III). Тетраэдрические комплексы [FeX4]- формируются главным образом с объемными анионными лигандами, например хлоридом и бромидом.
Соединения Fe(III) – слабые окислители в кислой среде
Fe2(SO4)3+ H2S = 2FeSO4+ H2SO4+ S
Fe2(SO4)3+ SO2+ 2H2O = 2FeSO4+ 2H2SO4
2Fe2(SO4)3+ 2(NH3OH)HSO4= 4FeSO4+ N2O + 4H2SO4+H2O
Fe2(SO4)3+ 2KI = 2FeSO4+ K2SO4+ I2
3. Способы выражения концентраций растворов и их взаимный пересчет.
· Массовая доля растворённого вещества w - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:
W = m(B) / m (р-ра)*100%
· Молярная концентрация C (молярность ) - показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C=n/v (моль/л)
· Нормальность раствора - обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту.
Cf=nf/v (моль/л)
· Моляльность - концентрация раствора, выраженная числом молей (грамм-молекул ) растворённого вещества, содержащегося в 1000 г растворителя.
b= n/1000г/рас-ля (моль/кг)
· Мольная доля - концентрация, выраженная отношением числа молей вещества к общему числу молей всех веществ, имеющихся в растворе.
Х=nвещ-ва/nвещ-ва+nр-ля
Дата добавления: 2015-08-11; просмотров: 5133;
