БИЛЕТ 19.
1. Щелочноземельные металлы, общая характеристика. Особое поведение Be и Mg. Сравнение кислотно-основных свойств гидроксидов. Соли. Важные радиоактивные изотопы 226Ra и 90Sr.
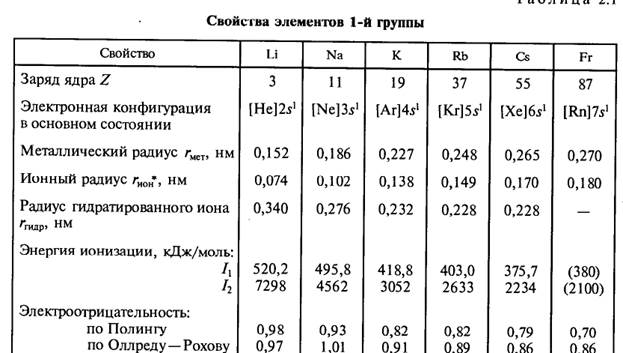
Радиус атомов щелочных металлов rмет возрастает при движении вниз по группе, это характерно для элементов всех главных групп. Относительно малое увеличение радиуса при переходе от калия к рубидию и далее к цезию связано с заполнением 3d- и 4d-подуровней соответственно. Это приводит к уменьшению экранирования ядра и увеличению его эффективного заряда.
Ионные радиусы щелочных металлов существенно меньше металлических, что связано с потерей единственного валентного электрона. Они также закономерно возрастают от Li+ к Cs+. Размеры же гидратированных катионов изменяются в противоположном направлении, что объясняется в рамках простейшей электростатической модели. Наименьший по размеру ион Li+ сильнее других притягивает к себе полярные молекулы воды, образуя наибольшую гидратную оболочку.
Единственный электрон на внешнем энергетическом уровне атома щелочного металла слабо связан с ядром, это подтверждают низкие значения энергии ионизации I1. Атомы щелочных металлов легко ионизируются с образованием ионов М+, входящих в состав большинства химических соединений этих элементов. Значения I2 для всех щелочных металлов настолько высоки, что в реально осуществимых условиях ион М2+ не образуется.
Электроотрицательность щелочных элементов мала, их соединения с наиболее электроотрицательными элементами (галогениды, нитриды и т.п.) являются ионными, во всяком случае, в кристаллическом состоянии.
Небольшой ионный радиус и высокая плотность заряда, характерные для иона Li+, приводят к тому, что соединения лития оказываются близкими по свойствам однотипным соединениям магния (диагональное сходство) и в то же время отличаются от соединений других щелочных металлов.
Все металлы первой группы — сильные восстановители, поэтому их получение требует высоких энергетических затрат.
Обнаружение щелочных металлов. Атомы, находящиеся в состоянии одноатомного пара, при тепловом воздействии переходят в возбужденное состояние: валентный электрон с s-подуровня переходит на р- или d-подуровень. Такое состояние крайне неустойчиво, и атом возвращается в основное состояние, испуская квант света определенной длины волны. Если его энергия оказывается в видимой части спектра и имеет высокую интенсивность, этот переход приводит к появлению окраски.
Соли натрия окрашивают пламя в характерный желтый цвет. Другие щелочные металлы также легко обнаружить по окрашиванию пламени: литий окрашивает пламя в карминово-красный цвет, калий — в фиолетовый, рубидий и цезий — в розово-фиолетовый. Следует, однако, иметь в виду, что в присутствии натрия их окраска незаметна.
Физические свойства.
В свободном виде элементы первой группы представляют собой легкоплавкие серебристо-белые (литий, натрий, калий, рубидий) или золотисто-желтые (цезий) металлы, обладающие высокой мягкостью и пластичностью.
Химические свойства.
Все металлы первой группы химически очень активны, что обусловлено низкими значениями энергий атомизации и ионизации. Значения стандартных электродных потенциалов Е°(М+/М) отрицательные. Вниз по группе разность суммарных значений энергий процессов атомизации, ионизации и гидратации нивелируется, что приводит к равенству потенциалов Е°(М+/М) в растворе для лития и цезия.
Все щелочные металлы взаимодействуют с водой, выделяя водород:
2М(тв.) + 2Н20 = 2М+(Р.) + 2OН-(р.) + Н2(г.)
Все щелочные металлы легко окисляются кислородом, галогенами, а при нагревании взаимодействуют с водородом, серой, фосфором. С азотом легко реагирует лишь литий. Хотя эта реакция медленно протекает даже при комнатной температуре, обычно ее проводят при 350 °С.
При нагревании лития или натрия с углем или ацетиленом образуются ацетилениды М2С2. Калий, рубидий и цезий карбидов не образуют, однако способны внедряться между слоями графита, образуя соединения включения типа СnМ (n = 8, 24, 36, 48, 60).
Сплавы щелочных металлов со ртутью называют амальгамами. Амальгама натрия (жидкая при малом содержании Na) — удобный восстановитель при проведении синтеза в водном растворе, так как она довольно медленно и спокойно разлагается водой.
Щелочные металлы прекрасно растворяются в жидком аммиаке с образованием окрашенных растворов, цвет которых зависит от концентрации.
Щелочные металлы могут восстанавливать другие металлы из их оксидов и галогенидов. Взаимодействие хлорида алюминия с натрием:
AlCl3 + 3Na = Al + 3NaCl
использовалось еще в XIX в. для получения алюминия.
Щелочные металлы активно реагируют с кислотами, но так как эти реакции протекают очень бурно, то они не имеют практического значения, поскольку соответствующие соли гораздо проще получать нейтрализацией гидроксидов.
Бериллий — один из самых легких металлов, диамагнетик, имеет высокую теплопроводность и высокую температуру плавления (1289 °С), устойчив к окислению на воздухе, характеризуется низким сечением захвата нейтронов. Благодаря этому бериллий и сплавы на его основе (бериллиевые бронзы) применяют в самолето- и ракетостроении, ядерной энергетике, при производстве рентгеновских трубок и т.д.
Важное практическое значение имеют магний и в первую очередь его сплавы с алюминием и некоторыми редкоземельными металлами. Присутствие магния придает материалам большую механическую прочность и устойчивость к коррозии и в то же время «легкость» (плотность магния 1,74 г/см3), поэтому магний- алюминиевые сплавы (магналий, электрон и др.) используются для изготовления деталей в самолето- и автомобилестроении, различных инструментов.
Порошок магния используется в сигнальных ракетах, а некоторые его соединения —жженая магнезия MgO или горькая соль MgS04 • 7Н20 находят применение в медицине.
Соли.
Большинство солей элементов первой группы хорошо растворимы в воде, но (за исключением солей лития) практически нерастворимы в неводных растворителях.
Одной из причин низкой растворимости этих солей является высокая энергия кристаллической решетки, что достигается при структурном соответствии (близости размеров) катиона и аниона.
Термическая устойчивость солей кислородных кислот (карбонатов, сульфатов, фосфатов) возрастает вниз по подгруппе, изменяясь симбатно росту радиуса и усилению степени ионности связи.
2. Актиноиды и лантаноиды.
В отличие от лантана и лантаноидов актиний и все 5d-элементы радиоактивны, т.е. не имеют стабильных изотопов. И если для тория и урана существуют изотопы, период полураспада которых измеряется миллиардами лет, то некоторые трансурановые элементы живут лишь минуты, что создает значительные трудности в изучении их химических свойств.
В атомах актиноидов, как и в атомах лантаноидов, происходит заполнение f-подуровня. Однако у актиния и находящегося за ним тория электрон заполняет 6d-орбиталь. Таким образом, актиний и торий в невозбужденном состоянии не являются f-элементами. У следующих за торием элементов число f-электронов (они впервые появляются у атома протактиния) последовательно увеличивается, достигая 14 у атома нобелия. Монотонное возрастание числа f-электронов нарушается, как и в случае лантаноидов, в середине ряда, что связано с повышенной устойчивостью наполовину заполненного подуровня. Как пример сходства с 4f-элементами следует отметить большой размер атома и высокие координационные числа (как правило, от 7 до 10; максимально 14).
Изменение энергии ионизации и орбитального радиуса подчиняется закономерностям, наблюдаемым у лантаноидов. Однако при внешнем подобии электронных конфигураций 4f- и 5f-элементов между ними существует ряд принципиальных различий.
1. Ни один 5f-элемент не имеет стабильных изотопов. Периоды полураспада наиболее долгоживущих изотопов актиноидов в целом имеют тенденцию к резкому убыванию с ростом порядкового номера.
2. Орбитали 5f и 6d близки по энергии, и переходы электронов между ними происходят с большой вероятностью. С этим, в частности, связана сложность определения основного электронного состояния атомов актиноидов, что нашло отражение, где для некоторых атомов приведено несколько электронных конфигураций. Спин-орбитальное взаимодействие в ионах актиноидов очень сильно, а расщепление, обусловленное спин-орбитальным взаимодействием, в ряде случаев сравнимо с расщеплением кристаллическим полем.
3. Электроны 5f по сравнению с 4f имеют более высокую энергию, их электронные облака более диффузны. Эти орбитали не являются внутренними, что особенно заметно выражено у элементов первой половины ряда (у лантаноидов это могло бы относиться только к церию). При переходе от тория к лоуренсию энергия орбиталей понижается, причем по-разному для 5f- и 6d - орбиталей, так что условно можно выделить семейства актиноидов первой и второй половины ряда.
Тенденция к уменьшению размера 5f-электронной оболочки с ростом заряда ядра, приводящая к последовательному уменьшению ионного радиуса, носит название актиноидного сжатия. Оно аналогично лантаноидному сжатию, описанному на примере 4/-элементов.
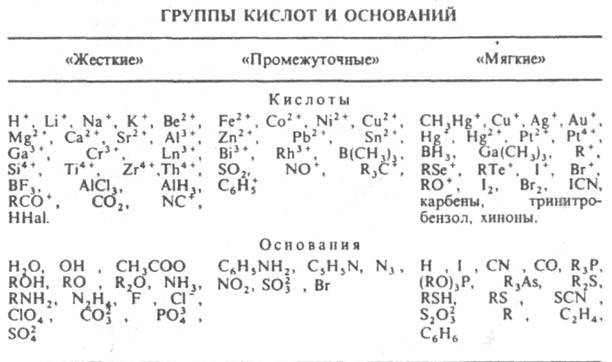
3. Жесткие мягкие кислоты и основания
(принцип ЖМКО): кислотно-основные взаимодействия протекают таким образом, что "жесткие" кислоты предпочтительно связываются с "жесткими" основаниями, а "мягкие" кислоты - с "мягкими" основаниями. При оценке "жесткости" и "мягкости" кислот и оснований учитывают их химический состав и электронное строение, а также сравнительную устойчивость образуемых ими кислотно-основных комплексов: А + :В D А : В, где А - кислота Льюиса, :В - основание, А : В - кислотно-основной комплекс. "Жесткие" кислоты - акцепторы с низкой поляризуемостью, высокой электроотрицательностью, трудно восстанавливаются, их незаполненные граничные орбитали имеют низкую энергию; "мягкие" кислоты - акцепторы с высокой поляризуемостью, низкой электроотрицательностью, легко восстанавливаются, их свободный граничные орбитали имеют высокую энергию. "Жесткие" основания - доноры с низкой поляризуемостью, высокой электроотрицательностью, трудно окисляются, их занятые граничные орбитали имеют низкую энергию; "мягкие" основания доноры с высокой поляризуемостью, низкой электроотрицательностью, легко окисляются, их занятые граничные орбитали имеют высокую энергию. Самая "жесткая" кислота - протон, самая "мягкая" CH3Hg+; наиболее "жесткие" основания - F и ОН - , наиболее "мягкие" I - и Н -. Сопоставление устойчивости кислотно-основных комплексов для различные оснований по отношению к Н+ и CH3Hg+ , a также для кислот по отношению к F - и I - позволило разделить известные кислоты и основания на группы (см. табл.).
Дата добавления: 2015-08-11; просмотров: 2136;
