Билет 15
1. Подгруппа галлия. Сравнение кислотно-основных свойств Э(ОН)3. Сходство соединений Tl+ , Ag+ и ионов щелочных металлов. Комплексные соединения элементов III группы.
Элементы 13-й группы: бор В, алюминий А1, галлий Ga, индий In и
таллий Т1 — имеют мало стабильных изотопов, что характерно для атомов с
нечетными порядковыми номерами. Электронная конфигурация основного состояния ns*npl характеризуется наличием единственного неспаренного электрона.
Борная кислота представляет собой жирные на ощупь чешуйчатые кристаллы, в структуре которых молекулы В(ОН)3 связаны в плоские слои
за счет водородных связей —ОН—О. Отдельные слои соединены друг с другом слабыми межмолекулярными связями и находятся на значительном расстоянии друг от друга. Н3В03 растворяется в воде и является слабой
одноосновной кислотой. В отличие от обычных кислот ее кислотные свойства обусловлены не отщеплением иона водорода, а присоединением гидроксильной группы молекулы воды, выступающей в роли основания Льюиса: В(ОН)3 + Н-ОН = [В(ОН)4]-+ Н+
Кислотные свойства Н3В03 проявляются в том, что в присутствии концентрированной H2S04 (как водоотнимающего средства) со спиртами она образует эфиры: В(ОН)3 + ЗСН30Н = (СН30)3В + ЗН20
Гидроксиды алюминия, галлия и индия выделяются в виде аморфных осадков при действии аммиака на водные растворы их солей:
A12(S04)3 + 6NH3+ (x + 3)Н20 = А1203*xН20 + 3(NH4)2S04
Кристаллический гидроксид А1(ОН)3 можно получить, пропуская С02 через щелочные растворы алюмината натрия:
2Na[Al(0H)4(H20)2] + 2С02 = 2А1(ОН)3 + 2NaHC03 + 4Н20
В ряду А1—Ga—In—T1 усиливаются основные свойства гидроксидов. Так, если гидроксиды алюминия и галлия сравнительно легко растворяются в щелочах, то гидроксоиндаты образуются лишь при рН > 13, а Т1203 растворим только в кислотах.
Черный твердый оксид таллия Т120 подобно оксидам щелочных металлов реагирует с водой с образованием гидроксида. При концентрировании водных растворов ТIOН выделяется в виде желтых игл, темнеющих при хранении. Подобно гидроксидам щелочных металлов гидроксид таллия — сильное основание. Он хорошо растворяется в воде, спирте, разъедает стекло, поглощает углекислый газ:
2Т10Н + С02 = Т12С03 + Н20
Устойчивость соединений в низшей степени окисления возрастает вниз по группе, для таллия степень окисления +1 наиболее характерна. Свойства соединений Т1(1) похожи на свойства соответствующих галогенидов серебра. Хлорид таллия(1) Т1С1 служит исходным веществом для синтеза многих соединений таллия. Он представляет собой бесцветные кристаллы со структурой CsCl, малорастворимые в воде. На свету это вещество темнеет, так как разлагается на таллий и хлор. Соли таллия(1) по свойствам напоминают соединения серебра и калия. Ионы ТI+ и К+имеют близкие радиусы. Подобно калию ион таллия образует хромовые квасцы. Учитывая инертность электронной пары 6s2, легко заметить сходство в электронном
строении ионов Tl+ (4d106s2) и Ag+(5d10). Галогениды таллия подобно галогенидам серебра на свету разлагаются. Соли таллия с сильными кислотами подобно солям серебра в водных растворах практически не гидролизуются.
Атом бора, используя вакантную 2p-орбиталь, образует комплексные соединения с лигандами, обладающими неподеленными электронными парами. К их числу принадлежат тетрагидроксоборат-ион [В(ОН)4]-, тетрафтороборат [BF4]-, тетрагидроборат [ВН4]- и т.д. Химические связи во всех комплексных соединениях бора являются ковалентными, т.е. ион В3+
в них отсутствует.
Аммиакаты [MIII(NH3)6]3+ (МIII = Al, Ga, In) менее устойчивы по сравнению с аквакомплексами [МIII(Н20)6]3+, что обусловлено большей прочностью связи МIII—ОН2 по сравнению со связью МIII —NH3.
Характерно, например, что гидроксид алюминия, легко растворяющийся в избытке щелочи, в присутствии Н20 не взаимодействует с аммиаком. Поэтому для осаждения А1(ОН)3 из растворов солей А1(III) используют водный раствор NH3. Концентрация ОН--ионов недостаточна для образования гидроксоалюминатов [А1(ОН)4(Н20)2]-, а молекулы NH3 не могут вытеснить молекулы Н20 из координационной сферы для образования аммиаката.
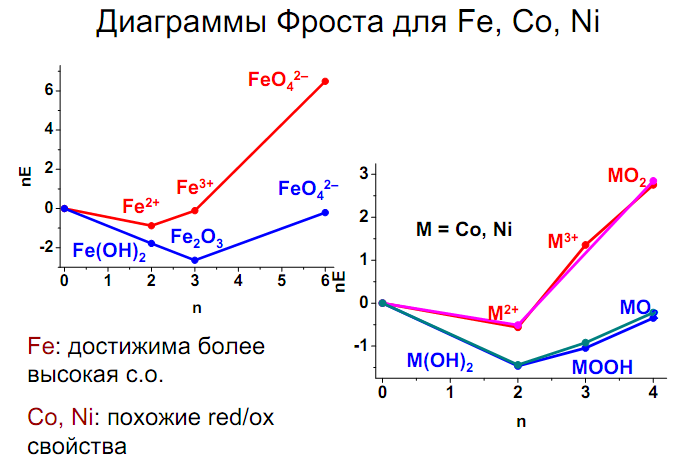
2. Триада железа (Fe, Co, Ni). Диаграммы окислительно-восстановительных свойств. Пирофорные свойства. Ферромагнетизм. Отношение металлов к воде, кислороду, растворам кислот и щелочей. Соединения Э2+: оксиды, гидроксиды, соли, комплексы.

Железо — серебристо-белый, ковкий и пластичный тугоплавкий металл, существующий в форме нескольких полиморфных модификаций. При температуре ниже 910 °С устойчива структура с объемно-центрированной кристаллической решеткой (a-Fe), она обладает ферромагнетизмом. При температуре 769 °С доменная структура разрушается, ферромагнитные свойства исчезают, и железо становится парамагнетиком (b-Fe). Этот фазовый переход сопровождается лишь небольшим расширением кристаллической решетки и резким увеличением теплоемкости; существенных изменений кристаллической структуры при этом не происходит. Дальнейшее нагревание до 910 °С приводит к возникновению более плотной модификации (y-Fe) с кубической гранецент-
рированной решеткой.
Кобальт представляет собой серовато-белый металл, ковкий и тягучий,
хорошо полирующийся. По твердости он превосходит сталь и труднее поддается пластической обработке. При температуре ниже 427 °С устойчива гексагональная а-модификация, которая при нагревании переходит в кубическую с гранецентрированной решеткой (b-Со).
По внешнему виду и физическим свойствам никель напоминает кобальт. Он кристаллизуется в кубической гранецентрированной решетке, хотя некоторые примеси способны стабилизировать метастабильную гексагональную структуру. В отличие от железа и кобальта никель хуже намагничивается и теряет ферромагнитные свойства при гораздо более низкой (358 °С) температуре.
При комнатной температуре в компактном виде железо не взаимодействует ни с кислородом, ни с водой, однако во влажном воздухе медленно ржавеет, покрываясь коричневой коркой гидратированного оксида Fe203*хН20 ржавчины. 4Fe + 3O2 + 2H2O = 4FeO(OH)
Fe,Co,Ni пассивируются концентрированными H2SO4, HNO3 и царской водкой.
Растворяются в кислотах-неокислителях
Co + 2HCl = CoCl2 + H2
10Fe + 36HNO3 (разб) = 10Fe(NO3)3 + 3N2 + 18H2O
5Ni + 12HNO3 (разб) = 5Ni(NO3)2 + N2 + 6H2O
Не растворяются в щелочах.
Реагируют с кислородом при нагревании
4Fe + 3O2 = 2Fe2O3
3Co + O2 = Co3O4
2Ni + O2 = 2NiO
В отличие от железа кобальт и никель не подвержены коррозии даже при хранении на влажном воздухе. Однако мелкодисперсный порошок кобальта, полученный разложением оксалата, пирофорен — он самораскаляется на воздухе. При нагревании на воздухе стружка металлов сначала медленно окисляется, а при температуре примерно 1 000 °С сгорает, образуя оксиды NiO и Со304.
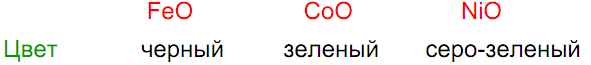
Только основные свойства FeO + 2HCl = FeCl2 + H2O
FeO, CoO окисляются при нагревании: 6CoO + O2 = 2Co3O4
Получение: FeC2O4= FeO + CO + CO2
Гидроксиды: преимущественно основные свойства
Ni(OH)2 + H2SO4 = NiSO4 + H2O
Co(OH)2 + 2KOH (конц) = K2[Co(OH)4]
6Fe(OH)2 + O2 = 2Fe3O4 + 6H2O окисление
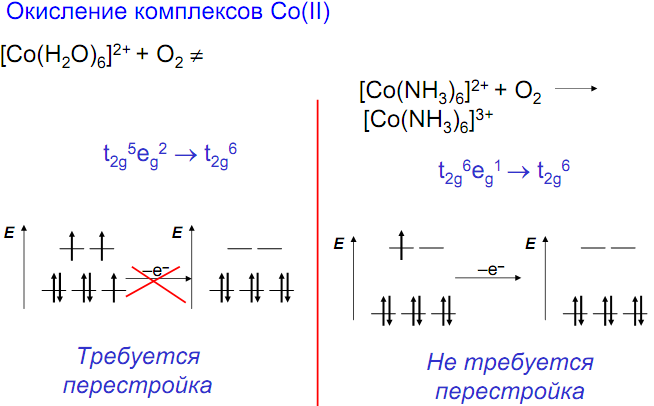
Стабильность аммиакатов увеличивается по ряду: Fe→Co→Ni
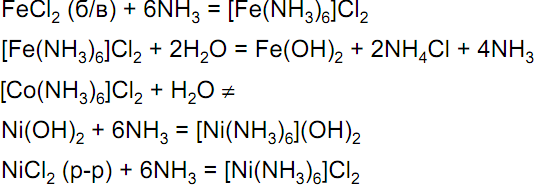

Дата добавления: 2015-08-11; просмотров: 2541;
