Инертные газы. Нахождение в природе и особенности получения. Клатраты. Фториды ксенона. Кислородные соединения ксенона.

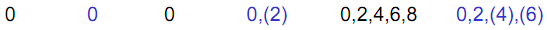
He –2й по распространенности элемент Вселенной.Всегда присутствует в природном газе в результате α-распада, до 7 об.%
Ar –0.93% в атмосфере
Ne, Kr, Xe – следовые количества в атмосфере
Rn – в продуктах распада 238U
Получение:
He, Ar - из природного газа, после сжижения остальных компонентов
Ne - остаток после сжижения воздуха
Kr, Xe - селективная адсорбция воздуха углем
Клатраты. Устойчивы при н.у. Не содержат химической связи между атомами и клатратной решеткой, кроме ван-дер-Ваальсова взаимодействия.
Клатраты построены по типу «гость-хозяин». Ng – гость, заключенный в решетку хозяина, несвязанный с ним ковалентными связями.
Типы клатратов Ng:

Образование и устойчивость клатратов определяется комплементарностью гостя и хозяина.
Для клатратов Ng : Комплементарность – соответствие формы и размера полости каркаса хозяина размеру сферического атома Ng
Устойчивость 8Ng@46H2O
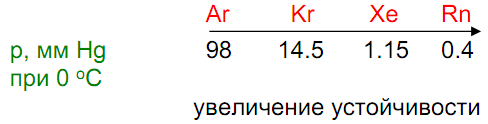
Получение: совместная кристаллизация при высоком давлении
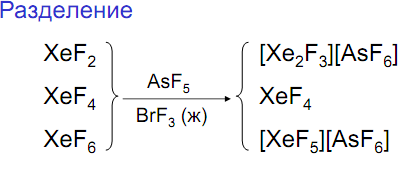
Фториды Xe – наиболее стабильные соединения Xe
Получение:

Гидролиз: 2XeF2 + 2H2O = 2Xe + 4HF + O2 медленно
6XeF4 + 12H2O = 2XeO3 + 4Xe + 24HF + 3O2
Фторирующие агенты, окислители
XeF6 > XeF4 > XeF2 только в лаборатории
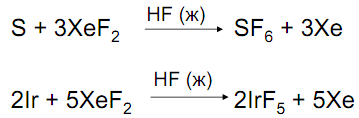
2XeF6 + SiO2 = 2XeOF4 + SiF4 не red/ox !
5XeF2 + 2MnSO4 + 2H2O = 5Xe + 2HMnO4 + 10HF + 2H2SO4
Строение XeF2
Строение всех фторидов Xe → метод Гиллеспи
Кислородные соединения Xe:
Оксиды Xe: 
Получение: XeF6 + 3H2O = XeO3 + 6HF
Na4XeO6 + 4H2SO4 (конц) = XeO4 + 4NaHSO4 + 2H2O
Свойства: XeO3 + KOH = K[HXeO4] гидроксоксенат
2K[HXeO4] + 2KOH (к) = Xe + O2 + K4XeO6 + H2O перксенат
4XeF6 + 18Ba(OH)2 = 3Ba2XeO6 + Xe + 12BaF2 + 18H2O
K4XeO6 + 2Na2SO4 + 8H2O = Na4XeO6·8H2O↓ + 2K2SO4
Окислители: 5XeO3 + 6MnSO4 + 9H2O = 5Xe + 6HMnO4 + 6H2SO4
K4XeO6 + 4MnO2 + 4KOH = 4K2MnO4 + Xe + 2H2O
2. Отношение к кислороду воздуха в кислой и щелочной средах. Соединения Э3+: оксиды, гидроксиды, соли, комплексные соединения. Моноядерные и полиядерные карбонилы. Правило Сиджвика. Металлоцены. Соединения Fe6+, получение окислительные свойства.
При электрохимической коррозии на аноде происходит окисление (разрушение) металла. Me(0) – ne → Me(n+)
На катоде во «влажном воздухе» в зависимости от газового состава атмосферы могут протекать два основных процесса – восстановление молекулярного кислорода или восстановление ионов водорода.
2H2O + О2 + 4e → 4OH(-) (рН ≥ 7 – среда нейтральная или слабощелочная)
2Н(+) + 2е → Н2↑ (рН < 7 – среда кислая)
+3 - наиболее устойчивая с.о. Fe
Известны оксид Fe и гидроксиды Fe, Co, Ni
Fe2O3 – красное кристаллическое вещество, 5 кристаллических модификаций, основные:
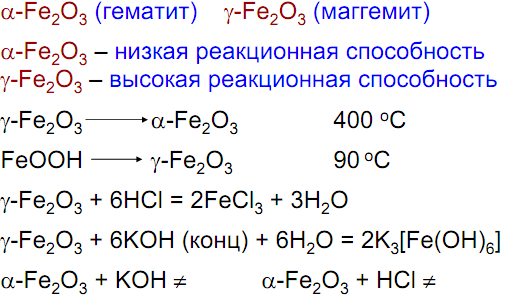
Гидроксиды:
Fe2(SO4)3 + 6KOH = 2Fe(OH)3 + 3K2SO4
2CoSO4 + 4KOH + H2O2 = 2Co(OH)3 + 2K2SO4
2NiSO4 + 6KOH + Br2 = 2NiOOH + 2KBr + 2K2SO4
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 3H2O коричневый
Fe(OH)3 + Ba(OH)2 (конц) = Ba[Fe(OH)5] белый
Co(OH)3 + 2H2SO4 (конц) = H[Co(SO4)2] + 3H2O зеленый
2Co(OH)3 + 2H2SO4 (разб) = 2CoSO4 + 1/2O2 + 5H2O
NiOOH + 4HCl = NiCl2 + Cl2 + 2H2O
Галогениды: Известны FeF3, FeCl3, FeBr3, CoF3, NiF3
2Fe + 3Cl2 = 2FeCl3
2Co + 3F2 = 2CoF3
Fe2O3 + 3C + 3Cl2 = 2FeCl3 + 3CO
FeCl3 + 6H2O = [FeCl2(H2O)4]Cl·2H2O
Комплексы Fe(III):
Аммиакаты неустойчивы
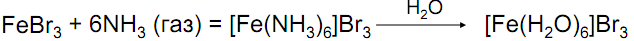
Устойчивы комплексы с π-лигандами и хелатные:
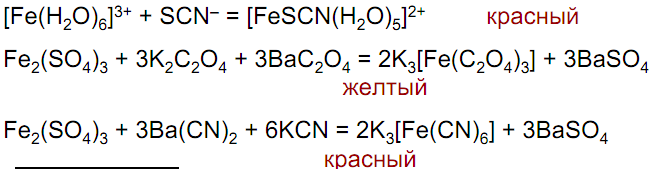
Соединения Fe(III) – слабые окислители в кислой среде
Fe2(SO4)3 + H2S = 2FeSO4 + H2SO4 + S
Fe2(SO4)3 + SO2 + 2H2O = 2FeSO4 + 2H2SO4
Fe2(SO4)3 + 2KI = 2FeSO4 + K2SO4 + I2
Влияние комплексообразования:
K3[Fe(С2О4)3] + KI ≠
4K3[Fe(CN)6] + 4KOH (конц) = 4K4[Fe(CN)6] + 2H2O + O2
Комплексы Co(III):
Устойчивы низкоспиновые комплексы Co(III) слигандами сильного поля
4K3[CoF6] + 2H2O = 12KF + 4HF + 4CoF2 + O2 быстро
Аквакомплекс низкоспиновый [Co(H2O)6]3+ сине-зеленый
2Co2(SO4)3 + 2H2O = 4CoSO4 + 2H2SO4 + O2 медленно
Aммиакаты:
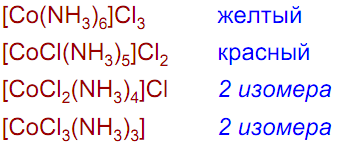
[Co(NH3)6]Cl3 + H2SO4 ≠
[Co(NH3)6]Cl3 + 3KI = [Co(NH3)6]I3↓ + 3KCl
[Co(NH3)6]Cl3 + 2SbF3 + 3KF = [Co(NH3)6](Sb2F9) + 3KCl
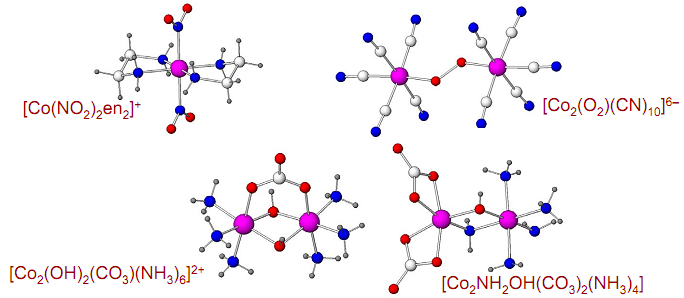
Хелатные и биядерные комплексы:
CoCl2 + 3NaNO2 + 2HCl + 2en = [Co(NO2)2en2]Cl + 3NaCl + NO + H2O
2CoCl2 + O2 + 10KCN = K6[Co2(O2)(CN)10] + 4KCl
Соединения элементов в низких степенях окисления представлены карбонилами. При взаимодействии тонко измельченного железа с CO при повышенных значениях температуры и давления образуется желтая жидкость состава Fe(CO)5, состоящая из тригонально-бипирамидальных молекул. При облучении ультрафиолетом жидкость превращается в золотисто-желтые кристаллы биядерного карбонила Fe2(CO)9 со связью металл—металл, который при нагревании до 100 °С распадается на Fe(CO)5 и треугольный карбонильный кластер Fe3(CO)12. Карбонилы:

Правило Сиджвика:
Другая трактовка: В комплексных соединениях центральный атом металла будет окружать себя таким числом лигандов, чтобы число электронов во внешней электронной оболочке было равно 18.
• 26Fe0 [Ar]3d64s2 || 36Kr
• 18 – 8 = 10e –
• или 36 – 26 = 10e –
• x = 10/2 = 5 эл.пар (5 молекулCO)
• [Fe(CO)5] пентакарбонилжелезо


Ни одна из этих теорий не является всеобъемлющей, поэтому возможно использование той, которая наилучшим образом описывает строение того или иного комплексного соединения.
Металлоцены - органические соединения, образованные переходным металлом и циклопентадиеном.
Молекулы металлоценов имеют вид «сэндвича»: ион металла со степенью окисления +2 находится между двумя параллельными циклопентадиенильными кольцами на равном от них расстоянии. В большей части металлоценов металл связан с лигандами ковалентной связью, но в манганоцене химическая связь образуется за счёт электростатического взаимодействия катиона Mn2+ и анионов C5H5. В хромоцене и ванадоцене связь иона металла с лигандами также имеет частично ионный характер. Взаимное расположение циклопентадиенильных колец зависит от соединения: если в ферроцене эти кольца находятся в призматической или антипризматической конфигурации, то в рутеноцене и осмоцене - в призматической.
Металлоцены имеют интенсивную окраску и хорошо растворяются во многих органических растворителях. Способны возгоняться. Такие соединения обладают ароматическими свойствами: вступают в реакции электрофильного замещения. Менее устойчив никелоцен. Другие металлоцены неустойчивы на воздухе и быстро окисляются.
Никелоцен способен обменивать свои циклопентадиенильные кольца на другие лиганды при взаимодействии с Ni(CO)4, NO, KCN в среде жидкого аммиака, а также присоединять к непредельные соединения. Кобальтоцен окисляется водой с выделением молекулярного водорода и образованием кобальтоцениевого катиона [(C5H5)2Co]+, а с галогеноводородами образует соль кобальтоцения и устойчивые комплексные соединения:
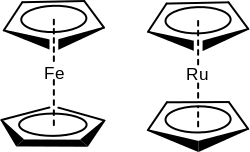 Ферроцен и рутеноцен
Ферроцен и рутеноцен
Соединения щелочноземельных металлов M2Fe04 имеют структуру шпинели. В воде все они диспропорционируют на ферраты(VI) и гидроксид железа(Ш): 3Na4Fe04 + (5 + х)Н20 = Na2Fe04 + Fe203*xH20 + lONaOH
Среди соединений железа в высшей степени окисления в водной среде
(рН > 8) устойчив лишь феррат(VI), образующий красно-фиолетовые растворы. Ферраты получают окислением гидроксида железа(Ш) гипохлоритом, бромом или хлором в щелочной среде:
2Fe(OH)3 + ЗВг2 + 10КОН = 2K2Fe04 + 6КВг + 8Н20
а также анодным окислением железа или сплавлением железных стружек с
селитрой. Твердые ферраты(VI) термически менее устойчивы, чем ферраты(V) и ферраты(IV), поэтому при сильном нагревании они восстанавливаются: 2K2Fe04 = K3Fe04 + KFe02 + 02
Ферраты — сильные окислители, особенно в кислой среде. Даже на холоду они окисляют аммиак, гидразин и метилгидразин до азота, превращаясь в соединения железа(Ш) , а при избытке гидразина и его производных — и в соли железа(II):
2K2Fe04 + 2NH3 + (x - 1)Н20 = Fe203 • xH2O + N2 + 4KOH
Концентрированная соляная кислота реагирует с ферратами с выделением
хлора, сернистый газ превращается в сульфаты, соли марганца(II) — в пер-
манганаты: 2K2Fe04 + 16НС1 = 2FeCl3 + 3Cl2 + 8Н20 + 4КС1
Водные растворы ферратов со временем разлагаются, выделяя кислород.
Процесс сильно ускоряется даже при слабом подкислении:
4K2Fe04 + 10H2SO4 = 2Fe2 (S04 ) 3 + 302 + 4K2S04+ 10H2O
Дата добавления: 2015-08-11; просмотров: 3295;
