Расщепление d-орбиталей в октаэдрическом и тетраэдрическом кристаллическом поле лигандов.
Теория кристаллического поля (ТКП):, связь между комплексообразователем и лигандами ионная. Лиганды – бесструктурные заряженные точки, создающие электростатическое поле. ТКП рассматривает влияние поля лигандов на комплексообразователь. Вырождение орбиталей(имеющие одинаковую энергию) в несферическом поле лигандов частично снимается. Причина снятия вырождения – различие в форме d-орбиталей и их ориентации в пространстве.
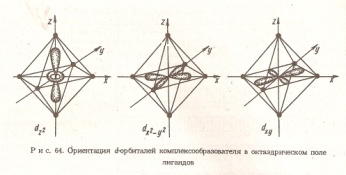
Электронная плотность орбиталей dz2 и dx2-y2 сконцентрирована вдоль координатных осей, тогда как орбитали dxy,dxz,dyz расположены по биссектрисам между осями. Поэтому электроны dz2 и dx2-y2 орбиталей испытывают со стороны отрицательно заряженных лигандов большее отталкивание, чем электроны трех других орбиталей, называемых de.Энергия dy-орбиталей повышается, а энергия de орбиталей понижается, происходит энергетическое расщепление. Энергия расщепления- дельта.
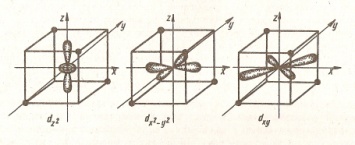
В тетраэдре ни одна из орбиталей не выходит на лиганды.
Dxy,dxz,dyz орбитали будут ближе к лиганде, они будут испытывать большее отталкивание со стороны лиганд.
Расщепление, получаемое в комплексах одного и того же комплексообразователя с различными лигандами, убывает в следующем порядке: CN->NO2->ЭДТА>NH3>CN->CNS->H2O>F->OH->CNS->Cl->Br->I-
Эта последовательность лигандов по создаваемому ими кристаллическому полю – спектрохимический ряд, т.к. он получен из данных спектров поглощения комплексов.
Распределение электронов комплексообразователя по расщепленным энергетическим уровням в слабом поле подчиняется общим правилам и принципам:
1 первоочередного заполнения наиболее низких уровней;
2 правило Гунда (на вырожденных орбиталях суммарное спиновое число электронов должно быть максимальным)
3 принцип Паули (в любой многоэлектронной системе в каждом состоянии, определяемом полным набором 4 квантовых чисел, не может быть больше одного электрона).
Дата добавления: 2015-08-11; просмотров: 3749;
