Комплексные соединения d-элементов. Химия водных растворов: гидролиз, полимеризация, поликонденсация. Реакции замещения лигандов. Координационные числа. Степени окисления.
Реакции замещения, присоединения или отщепления лигандов, в результате которых изменяется координационная сфера металла.
В широком смысле под реакциями замещения понимают процессы замещения одних лигандов в координационной сфере металла другими
Диссоциативный (D) механизм. Двухстадийный процесс в предельном случае протекает через интермедиат с меньшим координационным числом:
ML6 <—> [ML5] + L; [ML5] + Y —-» ML5Y
Ассоциативный (А) механизм. Двухстадийный процесс, характеризуется образованием интермедиата с большим координационным числом: ML6 + Y = [ML6Y]; [ML6Y] = ML5Y + L
Механизм взаимного обмена (I). По этому механизму протекает большинство реакций обмена. Процесс одностадийный и не сопровождается образованием интермедиата. В переходном состоянии реагент и уходящая группа связаны с реакционным центром, входят в его ближайшую координационную сферу, и в процессе реакции происходит вытеснение одной группы другой, обмен двух лигандов:
ML6 + Y = [L…ML5 …Y] = ML5Y+L
Внутренний механизм. Этот механизм характеризует процесс замещения лигандов на молекулярном уровне.
2. Особенности свойств лантаноидов (Ln), связанные с эффектом лантаноидного сжатия. Соединения Ln3+: оксиды, гидроксиды, соли. Другие степени окисления. Примеры восстановительных свойств Sm2+, Eu2+ и окислительных свойств Ce4+, Pr4+.
Монотонное уменьшение атомных и ионных радиусов при движении по ряду 4f-элементов получило название лантаноидного сжатие. я. Оно приводит к тому, что радиусы атомов следующих за лантаноидами 5d-переходных элементов четвертой (гафний) и пятой (тантал) групп оказываются практически равными радиусам их электронных аналогов из пятого периода: циркония и ниобия соответственно, а химия тяжелых 4d- и 5d-металлов имеет много общего. Другим следствием f-сжатия является близость ионного радиуса иттрия к радиусам тяжелых f-элементов: диспрозия, гольмия и эрбия.
Все РЗЭ образуют устойчивые оксиды в степени окисления +3. Они представляют собой тугоплавкие кристаллические порошки, медленно поглощающие углекислый газ и пары воды. Оксиды большинства элементов получают прокаливанием на воздухе гидроксидов, карбонатов, нитратов, оксалатов при температуре 800— 1 000 °С.
Образуют оксиды M2O3 и гидроксиды M(OH)3
Только гидроксид скандия амфотерен
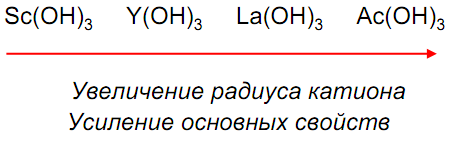
Оксиды и гидроксиды легко растворяются в кислотах
Sc2O3 + 6HNO3 = 2Sc(NO3)3 + 3H2O
Y(OH)3 + 3HCl = YCl3 + 3H2O
Только соединения скандия гидролизуются в водном растворе
[Sc(H2O)6]Cl3 ⇔ [Sc(OH)(H2O)5]Cl2 + HCl
Известны все галогениды в степени окисления +3. Все – тугоплавки.
Фториды плохо растворимы в воде. Y(NO3)3 + 3NaF = YF3↓+ 3NaNO3
Лантаниды: степени окисления +3 для всех элементов, а также Ce4+, Eu2+
Дигалогениды LnX2 получают восстановлением тригалогенидов:
2SmCl3 + Sm = 3SmCl2
2Eu(OH)2*Н20 = 2Еu(ОН)3 + Н2
Ce2(S04)3 + (NH4)2S208 = 2Ce(S04)2 + (NH4)2S04
4Се(ОН)3 + 02 + (4х - 6)Н20 = 4Се02*хН20
2Се(ОН)3 + ЗН202 = 2Ce(OH)3(OOH) + 2Н20
Дата добавления: 2015-08-11; просмотров: 2527;
