БИЛЕТ 20.
1. Серебро, Степени окисления. Взаимодействие металла с кислородом, галогенами, серой, растворами цианидов, кислот-окислителей. Соединения Ag+: оксид, соли, комплексы. Окислительные свойства соединений Ag2+ и Ag3+.
Ag - серебро
Электронная конфигурация 4d105s1
С.O.: 1,(2),(3)
Т.пл., оС = 961 ; Т.кип., оС = 2175
Ag, Au – благородные металлы, не реагируют с кислородом.
Ag окисляется в кислой среде
Ag + 2HNO3(конц) = AgNO3+ NO2+ H2O
2Ag + 4HI (конц) = 2H[AgI2] + H2
4Ag + 2H2S + O2= 2Ag2S + 2H2O очень медленно
6Ag + 3H2O2+ 3NaH2PO4= 2AgPO4+ Na3PO4+ 6H2O
Ag, Au растворяются в цианидах
4Ag + 8NaCN + O2+ H2O = 4Na[Ag(CN)2] + 4NaOH
Ag, реагируют с галогенами, халькогенами, P
2Ag + Cl2= 2AgCl
4Ag + 3P2= 2Ag2P3
Высшие с.о. Cu, Ag
Кислородные соединения Ag (III)
7AgNO3+ 8H2O = Ag7O8NO3+ 6HNO3+ 5H2 , где 2Ag1++5Ag3+
Гетерополисоединения
Na6H3[AgIII(TeO6)2]·20H2O
Соединения Ag (II)
Фторид Ag(II)
AgF + ½F2=AgF2 темно-коричневый, т.пл. 690 оС
AgF2+ KF = K[AgF3]
AgF2+ BaF2=Ba2[AgF6]
AgF2+ 2H2O = AgF + O2+ HF
Оксид Ag(II)
2AgNO3+ 4KOH + K2S2O8= 2AgO + 2K2SO4+ 2H2O + 2KNO3
диамагнитен AgIAgIIIO2, т.разл. = 110 оС
AgO + 2HClO4+ 3H2O = Ag(ClO4)2·4H2O [Ag(H2O)4]2+ d9
2AgO + 4HCl = 2AgCl + Cl2+ 2H2O
E0(Ag2+/Ag+) = 1.98 В
Соли Ag(II)
AgF2+ 2SbF5= Ag(SbF6)2 (в присутствии HF)
Ag(SbF6)2+ K2SO4 = AgSO4+ 2KSbF6 (в присутствии HF)
Оксид Ag(I).
Ag2O коричневый, т.разл. = 370 оС
Оксиды нерастворимы в воде, гидроксиды неустойчивы
Ag2O + H2O ⇔ 2Ag++ 2OH– pKb= 2.3
Ag2O + 2HNO3= 2AgNO3+ H2O
Ag2O + KOH ≠
2AgNO3+ 2KOH = Ag2O + 2KNO3+ H2O
Ag2O + 4NH3+ H2O = 2[Ag(NH3)2]OH
Галогениды Ag(I).
AgF – белый ; т.пл. 435 оС
AgCl – белый; т.пл.457 оС
AgBr - светло-желтый; т.пл. 434 оС
AgI – желтый; т.пл. 560 оС
AgF растворим в воде
AgNO3+ NaX = AgX↓ + NaNO3 X = Cl, Br, I
AgCl + 2NH3= [Ag(NH3)2]Cl lgβ = 11.2
AgI + 2KCN = K[Ag(CN)2] + KI lgβ = 19.9
AgBr + 2Na2S2O3= Na3[Ag(S2O3)2] + NaBr
Кислородные соли Ag(I)
AgNO3 = Ag + NO2+ ½O2
AgClO4 = AgCl + 2O2
AgNO3+ Ag2S = [Ag3S](NO3)
AgNO3+ AgBr = [Ag3Br](NO3)2
Низшие с.о. Ag
Субфторид серебра
AgF + Ag = Ag2F бронзовый металлический проводник
2. Краткая характеристика соединений An4+ (Th, U), An5+ (Pa).
Только Th и U получают химическими методами.
Th распространен также, как и свинец (0.0001 мас.%)
Основные минералы:
монацит (Ln,Th)PO4, торит Th(SiO4)2.
U в 2 раза меньше в земной коре, чем Th.
Основные минералы карнотит и урановая смолка
K2O⋅2UO3⋅V2O5⋅3H2O и U3O8
UF4+ 2Mg = 2MgF2+ U
Химия тория
Реагирует с кислотами
Th + 4HCl = ThCl4+ 2H2
Th + HNO3(конц) ≠
Реагирует с неметаллами
Th + O2= ThO2 ThIV
Th + 2Cl2= ThCl4 ThIV
Th + 2I2= ThI4 ThIV
Th + H2= ThH2 ThII
Оксид и гидроксид тория
Оксид тугоплавок
Th(OH)4= ThO2+ 2H2O Т.пл. = 3220 оС
Гидроксид ThIV нерастворим в воде
ThCl4+ 4NH3·H2O = Th(OH)4↓ + 4NH4Cl ПР = 10−42
Th(OH)4+ 4HNO3= Th(NO3)4+ 4H2O
Th(OH)4+ 2H2SO4= Th(SO4)2+ 4H2O
Соли ThIV устойчивы в растворе, не гидролизуются
Th(NO3)4+ 8H2O ⇔ [Th(H2O)8]4++ 4NO3−
Th(OH)4+ CO2= ThOCO3+ 2H2O во влажном воздухе
Известны пероксиды
4Th(NO3)4+ 6H2O2+ 2H2O = Th4O14+ 16HNO3
Галогениды тория
ThF4(тв) + NH4F (р-р) = (NH4)3[ThF7] аналог Zr
ThF4(тв) + NH4F (р-р) = (NH4)4[ThF8] аналог Hf
ThCl4+ 2KCl = K2[ThCl6]
Комплексы тория
Высокие координационные числа
Th(NO3)4+ 3KNO3= K3[Th(NO3)7] К.ч. = 7
Th(NO3)4+ 4(NH4)2C2O4= (NH4)4[Th(C2O4)4] + 4NH4NO3 К.ч. = 8
2Th(OH)4+ 2H3PO4+ NaH2PO4= Na[Th2(PO4)3] + 8H2O К.ч. = 9
ThOCO3+ 4Na2CO3+ H2O = Na6[Th(CO3)5] + 2NaOH К.ч. = 10
Th(OH)4+ 5Na2CO3= Na6[Th(CO3)5] 4NaOH
ThCl4+ 4Na(cp) = Th(cp)4+ 4NaCl К.ч. = 20
Восстановление тория(IV)
Реакции сопропорционирования
3ThI4+ Th = 4ThI3 в вакууме, при 700 оС
15ThBr4+ 9Th = 4Th6Br15 в вакууме, при 850оС
15ThBr4+ 9Th + 4Fe = 4Th6(Fe)Br15
Реакции тория с неметаллами
2Th + 3S = Th2S3 в атмосфере аргона
Восстановление солей ThIV
2Th(SO4)2+ 2HN3= Th2(SO4)3+ 3N2+ H2SO4
соли ThIII устойчивы только в сильно кислой среде
Химия урана
Уран – активный металл
3U + 4O2= U3O8 медленно при н.у.
U + 2H2O = UO2+ 2H2 выше 200 оС бурно
2U + 3H2= 2UH3(to)
Реакции с галогенами
U + F2= UF6 UVI
U + 5/2Cl2= UCl5 UV легко разлагается
U + 2Br2= UBr4 UIV
U + 3/2I2= UI3 UIII
Реакции с кислотами
U + 4HCl = UCl4+ 2H2 UIV
U + 4HNO3= UO2(NO3)2+ 2NO + 2H2O UVI
Соединения урана(VI)
UF6 – окислитель и фторирующий агент
UF6+ H2O = UOF4+ 2HF
Кислородные соединения UVI устойчивы
3U3O8+ 20HNO3(конц) = 9UO2(NO3)2+ 2NO + 10H2O
3U3O8+ 18HCl + 2HNO3= 9UO2Cl2+ 2NO + 10H2O
Пероксид UVI
UO2(NO3)2+ 2H2O2= UO2(O2)⋅H2O↓ + 2HNO3
Оксид и гидроксид UVI
UO2(NO3)2+ 2NaOH = UO2(OH)=↓ + 2NaNO3 ПР = 10−22
UO2(OH)2= UO3+ H2O выше 420 оС
Амфотерность
UO3+ H2O = UO2(OH)2 медленно, при н.у.
2UO2(NO3)2+ 6KOH = K2U2O7↓ + 4KNO3+ 3H2O оранжевый
K2U2O7+ 4HCl = 2UO2Cl2+ 2NH4Cl + H2O
Комплексы урана(VI)
Комплексы UVI делают уран похожим на d-металлы
Rb2U2O7+ 6Rb2CO3+ 3H2O = 2Rb4[UO2(CO3)3] + 6RbOH
UO2(CH3COO)2+ Zn(CH3COO)2= Zn[UO2(CH3COO)3]2 желтый, растворим
3Zn[UO2(CH3COO)3]2+ 2NaCl + 6H2O = 2NaZn[UO2(CH3COO)3]3⋅6H2O↓ + +ZnCl2 желтый осадок
K2U2O7+ 10KNCS + 3H2O = 2K3[UO2(NCS)5] + 6KOH
Соединения урана в низких с.о.
1. Оксиды
U3O8+ 2CO = 3UO2+ 2CO2U3O8+ 2H2= 3UO2+ 2H2O
UO2 темно-коричневый, т.пл. = 2775 оС
2. Свойства UIV
UO2+ 4HF = UF4+ 2H2O зеленый, ПР = 6⋅10−22, т.пл.=1309 К
UO2SO4+ Zn + 2H2SO4= U(SO4)2+ ZnSO4+ 2H2O
U(SO4)2+ 4KOH = U(OH)4+ 2K2SO4 ПР = 10−52
U(OH)4 растворим только в кислотах
3. Окисление и восстановление UIV
5U(SO4)2+ 2KMnO4+ 2H2O = 5UO2SO4+ K2SO4+ 2MnSO4+ 2H2SO4
2U(SO4)2+ H2O → U2(SO4)3+ ½O2+ H2SO4
Химия плутония
Pu растворяется в кислотах-неокислителях, но нереагирует с водой и щелочами
2Pu + 6HCl = 2PuCl3+ 3H2
Соли Pu3+ окрашены в зеленый цвет
Pu демонстрирует наибольшее разнообразие с.о.
Pu + 3K2S2O8+ 4H2O = K2PuO4+ 2K2SO4+ 4H2SO4 PuVI
Pu + O2= PuO2(to) PuIV
2Pu + 3Cl2= 2PuCl3(to) PuIII
Pu + H2 = PuH2(to) PuII
Наиболее устойчивые степени окисления +3 и +4
3. Коррозия металлов
Электрохимическая коррозия металла. Это разрушение М в результате электрохимического взаимодействия его с компонентами окружающей среды. Такую коррозию вызывают, главным образом, примеси, содержащиеся в М, или неоднородность его структуры. В этом случае при контакте металла с раствором электролита (например, с влагой, поглотившей компоненты окружающей среды) на поверхности М возникает множество микрогальванических элементов.
Причем катодом чаще всего бывают примеси, а анодом, который растворяется, – частицы самого металла как более активного вещества. На катоде в кислой среде может выделяться водород, а в нейтральной – восстанавливаться кислород, растворенный в электролите ( 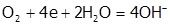 ), стимулируя окисление М («связыванием» его электронов).
), стимулируя окисление М («связыванием» его электронов).
Процесс электрохимической коррозии, очевидно, тем более термодинамически обусловлен (т.е. тем выше), чем дальше отстоят друг от друга вещества, образовавшие гальваническую пару (на поверхности металла), в ряду напряжений.
На практике часто защищают металлические (в частности, железные) изделия от коррозии (в том числе и от электрохимической), соединяя их с более активным М. Благодаря постепенному окислению этого металла (в образовавшемся ГЭ) обеспечивается электрохимическая защита самого изделия от коррозии.
Электродные процессы при электролизе. На характер электродных про-цессов большое влияние оказывает состав электролита. В частности, электролиз расплава и раствора одного и того же вещества часто протекает неодинаково из-за конкурирующего влияния частиц растворителя.
1). Процессы на катоде. При электролизе расплава соли на катоде выде-ляется металл, а в случае раствора катодный процесс может идти по-разному:
а) в нейтральной среде, если потенциал М более положителен, чем воды ( 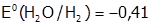 В), выделяется металл, например, медь:
В), выделяется металл, например, медь: 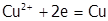
( 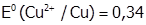 В).
В).
Если потенциал М более отрицателен, чем воды, как в случае натрия ( 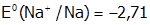 В), то выделяется водород:
В), то выделяется водород: 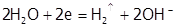 .
.
Если же потенциал металла близок к величине ( 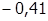 ) В (это М, расположенные в ряду напряжений между Mn и H2 ), то в зависимости от концентрации раствора, его температуры и силы тока возможно как восстановление металла, так и выделение водорода; часто оба процесса идут совместно.
) В (это М, расположенные в ряду напряжений между Mn и H2 ), то в зависимости от концентрации раствора, его температуры и силы тока возможно как восстановление металла, так и выделение водорода; часто оба процесса идут совместно.
б) в кислой среде, из-за возрастания потенциала водородной пары, не только термодинамически более обусловлен процесс выделения водорода ( 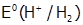 =0,00 B), но и механизм его восстановления становится другим:
=0,00 B), но и механизм его восстановления становится другим:
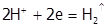 .
.
2). Процессы на аноде. Следует различать электролиз с инертным анодом (например, из графита или платины) и с растворимым анодом:
а) материал растворимого анода легче окисляется (т.е. его ОВП менее поло-жителен), чем анионы раствора. Таким материалом является, например, никель: 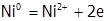
Используя в качестве растворимого анода металл с примесями, можно его очистить. При этом чистый М выделяется на катоде, а примеси, освобождающиеся при раство-рении анода, или остаются в растворе, или оседают на дно ячейки.
б) на инертном аноде при электролизе расплавов разряжаются анионы соли:
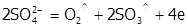 ,
, 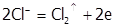 .
.
При электролизе же водных растворов HF и кислородосодержащих кислот (в кото-рых ц.а. имеет высшую ст.ок. а также их солей происходит окисление частиц воды, имеющих менее положительный потенциал [8]. Причем в щелочной среде разряжа-ются преимущественно гидроксильные ионы: 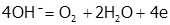 , а в кислой и нейтральной – молекулы воды:
, а в кислой и нейтральной – молекулы воды: 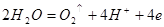 .
.
Напротив, бескислородные анионы ( S2-, I- и др.) обычно имеют потенциал окис-ления менее положительный, чем у воды, и поэтому окисляются на аноде не только при электролизе в расплаве, но и в водном растворе.
Перенапряжение. Характер продуктов электролиза часто определяется та-ким явлением, как перенапряжение. Это дополнительное напряжение по сравне-нию с расчетным, которое нужно приложить к электродам для окисления или вос-становления данных частиц.
Перенапряжение на катоде наблюдается, в частности, при электролитическом вы-делении водорода, причем его величина сильно зависит от материала катода и убывает в ряду: 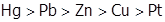 . Поэтому на ртутном катоде при электролизе раствора NaCl выделяется Na0 , а не H2 . По этой же причине растворение цинка в кислоте ускоряется, если привести его в контакт с металлической медью, на которой именно из-за меньшего перенапряжения и выделяется водород. Приведение же цинка в контакт со свинцом не влияет на скорость растворения Zn в кислоте, а водород при этом восстанавливается, как и до контакта, на цинке.
. Поэтому на ртутном катоде при электролизе раствора NaCl выделяется Na0 , а не H2 . По этой же причине растворение цинка в кислоте ускоряется, если привести его в контакт с металлической медью, на которой именно из-за меньшего перенапряжения и выделяется водород. Приведение же цинка в контакт со свинцом не влияет на скорость растворения Zn в кислоте, а водород при этом восстанавливается, как и до контакта, на цинке.
Перенапряжение на платиновом аноде делает потенциал разряда молекул воды (с выделением О2) более положительным, чем нужно для окисления даже хлоридов (до Cl2), хотя их Е0 без учета перенапряжения 0,82В и 1,36В соответственно.
Дата добавления: 2015-08-11; просмотров: 1795;
