Билет 13
1. Кремний. Взаимодействие с растворами щелочей и смесью кислот HF + HNO3. Силициды и силаны. Галогениды, их гидролиз. Диоксид кремния, кремневые кислоты. Силикаты.
Кремний — самый распространенный после кислорода элемент в земной коре (25,7 мас.%). Он входит в состав кварца Si02, силикатов и алюмосиликатов, слагающих земную кору.
Кремний получают восстановлением кварца углем или металлами. Кристаллы высокой степени чистоты образуются при восстановлении паров тетрахлорида кремния цинком или водородом: SiCl4 + 2Zn = Si + 2ZnCl2
Кремний кристаллизуется в кубической структуре типа алмаза. Кристаллический кремний представляет собой темно-серые кристаллы, твердые, но хрупкие. После полировки они приобретают синевато-серый блеск. Аморфный кремний представляет собой бурый порошок на основе сильно разупорядоченной алмазоподобной структуры. Кремний — полупроводник: его сопротивление понижается при повышении температуры. Кремний летуч.
Кремний в кислой среде покрывается нерастворимой пленкой Si02 и пассивируется. Кремний, а также германий растворяются в смеси концентрированных кислот (HN03 + HF, HN03 + HC1), при этом одна из них действует как комплексообразователь:
3Si + 4HN03 + 18HF = 3H2[SiF6] + 4NO + 8Н20
Кремний термодинамически неустойчив к диспропорционированию на силикат-ион Si032- и силан SiH4. Однако SiH4 в щелочном растворе легко окисляется с образованием водорода. Таким образом, кремний, особенно мелкодисперсный, растворяется в щелочах:
Si + 2NaOH + Н20 = Na2Si03 + 2H2
Кремний непосредственно с водородом не взаимодействуют, поэтому их гидриды получают действием тетрагидроалюмината лития на тетрахлориды, например: SiCl4 + Li[AlH4] = SiH4 + LiCl + A1C1
SiH4 активно взаимодействует с водой, причем гидролиз существенно ускоряется щелочами: SiH4 + 2NaOH + Н20 = Na2Si03 + 4Н2
Силан является сильным восстановителем:
SiH4 + 2AgCl = SiH3Cl + НС1 + 2Ag
Силан самопроизвольно загорается на воздухе: SiH4 + 202 = Si02 + 2Н20
Силициды щелочных и щелочноземельных металлов характеризуются преимущественно ионной связью и химически наиболее активны. Многие из них (например, KSi, BaSi2) состоят из катионов металла и тетраэдров Si44-.
Они легко разрушаются водой с выделением водорода:
Na2Si + 3H20 = Na2Si03 + ЗН2
или разбавленными кислотами с выделением SiH4 и других силанов:
Mg2Si + 2H2S04 = 2MgS04 + SiH4
Многие силициды переходных металлов обладают металлической проводи
мостью, которая вызвана перекрыванием частично заполненных d-орбиталей
металла.
В силицидах неметаллов осуществляется чаще всего ковалентная связь.Среди них особое место занимает карбид кремния (карборунд) SiC, имеющий структуру типа алмаза с чередующимися атомами Si и С. Карборунд характеризуется высокой твердостью и высокой температурой плавления. Он исключительно химически стоек по отношению к кислотам, в том числе HF, и окисляется кислородом только при температурах выше 1000°С. SiC + 202 = Si02 + C02
Кремний образует галогениды SiX4 со всеми галогенами: от газообразного SiF4 до твердого Sil4. В бесцветных SiXt прослеживается постепенное повышение температуры плавления и температуры кипения с ростом молекулярной массы.
Бесцветные летучие тетрагалогениды кремния получают взаимодействием кремния или карбида SiC с галогенами. Они состоят из молекул, имеющих форму правильного тетраэдра. В отличие от тетрагалогенидов углерода соединения SiX4 координационно ненасыщенны, поэтому быстро и полностью гидролизуются водой (кроме SiF4) с выделением SiO2*nН20. С хлоридами щелочных металлов они не реагируют.
Тетрафторид SiF4 при растворении в воде частично гидролизуется, а частично реагирует с выделяющимся фтороводородом:
2SiF4 + (n + 2)Н20 = H2SiF6 + Si02*nH20 + 2HF
Диоксид кремния широко распространен в природе. Он является главной составной частью кварцевого песка, присутствует в гранитах и песчаниках, а также встречается в виде горного хрусталя и ряда окрашенных форм — фиолетового аметиста, розового кварца, темно-коричневого мориона и др. При обычном давлении и температуре существуют три кристаллические
модификации диоксида кремния Si02: кварц, тридимит и кристобалит, устойчивые в определенной области температуры. Для каждой модификации известны низкотемпературные а- и высокотемпературные b-формы. Они построены из тетраэдров Si04, соединенных с соседними тетраэдрами всеми
четырьмя атомами кислорода в трехмерные решетки.
Взаимное расположение связанных тетраэдров Si04 в кристаллических модификациях Si02 совершенно различное, но между собой а- и b-формы отличаются незначительно. В целом низкотемпературные а-формы представляют собой немного искаженные высокотемпературные b-формы, поэтому переходы между ними протекают быстро и обратимо, без перестройки решетки.
Напротив, взаимные переходы между различными модификациями Si02 требуют разрыва связей Si—О—Si и их перестройки по другому пространственному мотиву, из-за чего такие превращения протекают медленно даже при высоких температурах.
Химические свойства различных модификаций сходны между собой. При высокотемпературном (t > 1000 °С) восстановлении Si02 простыми веществами (металлами, углеродом, водородом) образуется кремний:
SiO2 + 2Mg = Si + 2MgO Si02 + 2H2 = Si + 2H20
а при избытке восстановителя — силициды:
Si + 2Mg = Mg2Si Si02 + ЗС = SiC + 2CO
Оксид кремния(IV) проявляет кислотные свойства при взаимодействии с
растворами и расплавами щелочей, с основными оксидами и карбонатами:
Si02 + СаО = CaSi03
Все формы Si02 химически устойчивы к воздействию кислот, но растворяются (кроме стишовита) в плавиковой кислоте HF с образованием комплексной гексафторокремниевой кислоты H2[SiF6]:
Si02 + 6HF(p.) = H2[SiF6] + 2Н20
Si02 — ангидрид кремниевых кислот. Простейшая из которых ортокремниевая H4Si04 не выделена, так как при концентрировании претерпевает поликонденсацию. Она относится к слабым кислотам.
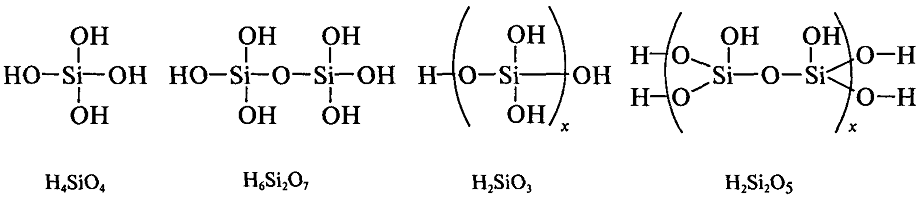
В воде растворимы только силикаты щелочных металлов и аммония. В растворе они гидролизуются. Процесс формально описывается реакцией:
Na2Si03 + Н20 = 2NaOH + H2Si03.
Фактически в растворе присутствует смесь полисиликатов.
Метасиликат натрия получают сплавлением Si02 с содой:
Si02 + Na2C03 = Na2Si03 + C02
Он представляет собой кристаллический порошок, состоящий из длинных
цепочек кремний-кислородных тетраэдров, связанных общими вершинами.
Силикат натрия хорошо растворим в воде, однако процесс растворения протекает медленно, сопровождается гидролизом и образованием золя кремниевой кислоты. Концентрированные растворы Na2Si03, называемые жидким стеклом, используют в качестве канцелярского клея.
2. Марганец, технеций, рений. Сравнение устойчивости соединений в разных степенях окисления на основе диаграмм окислительно-восстановительных свойств. Отношение металлов к растворам кислот и щелочей. Отличие Мn от аналогов. Сопоставление свойств оксидов, кислот, солей для Э7+.
Очевидна неравноценность разных степеней окисления этих элементов: так, для марганца характерны степени окисления +2 с электронной конфигурацией d5, отвечающей наполовину заселенному d-подуровню, и +4 с конфигурацией d3, соответствующей максимальной энергии стабилизации кристаллическим полем в октаэдрическом окружении. В то же время технеций и рений в водных растворах существуют преимущественно в высшей степени окисления. Таким образом, в ряду Мп — Тс — Re устойчивость соединений в высоких степенях окисления возрастает.
Cравнении энергий ионизации в группе Mn—Tc — Re. Первая энергия ионизации понижается от марганца к технецию из-за увеличения размера атома и ослабления связи валентного электрона технеция с ядром. Но при переходе к рению, несмотря на весьма близкие размеры атомов, происходит сильное повышение первой энергии ионизации. Это обусловлено инертностью электронной пары 6s2, характерной и для других элементов шестого периода, что способствует высокой устойчивости металлического рения к действию окислителей. Благодаря увеличению энергий ионизации для металлов седьмой группы можно ожидать существования всех положительных степеней окисления. Такие соединения действительно получены, но их стабильность различается весьма сильно.
Для марганца наиболее характерны соединения со степенями окисления +2, +4, +7. Вместе с тем легко доступны и производные марганца в степенях окисления 0, +3, +6. Для технеция типичные степени окисления +4, +6, +7; для рения +6, +7. Химия технеция и рения характеризуется легкостью взаимных превращений соединений с разными степенями окисления. В высшей степени окисления марганец значительно более сильный окислитель по сравнению с технецием(VII) и рением(VII). В этом отношении он даже превосходит соседний элемент хром(VI). Благодаря возможности спаривания d-электронов под действием лигандов сильного поля создаются условия для акцептирования электронных пар лигандов на освободившиеся орбитали центрального атома с образованием отрицательных степеней окисления -3, -2, -1 в карбонильных и нитрозильных производных.
Для марганца характерны координационные числа 4 и 6, хотя в некоторых комплексах, например в тетранитратоманганате [Mn(N03)4]2-, содержащем четыре бидентатные нитратные группы, оно достигает восьми. В химии технеция и особенно рения высокие координационные числа встречаются более часто, что объясняется ростом ионных радиусов.
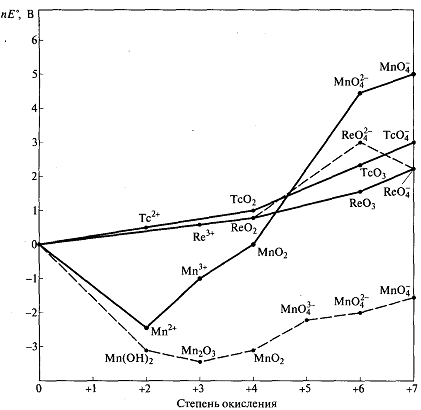
Анализ диаграммы для марганца.
•Частицы, вольт-эквиваленты которых находятся выше прямой, связывающей соседние точки диаграммы имеют тенденцию к диспропорционированию.
• Частицы, вольт-эквиваленты которых находятся ниже прямой, соединя
ющей соседние точки диаграммы (например, Мn02), в растворах не диспропорционируют.
• Сильные окислители находятся в правой верхней части диаграммы (МnО4-)
• Восстановители расположены в левой нижней части диаграммы (Мп).
• Диаграмма Фроста характеризует термодинамическую устойчивость частиц
в растворе к окислению и восстановлению. В некоторых случаях даже термодинамически возможные реакции протекают с крайне низкой скоростью, т.е. реально не осуществимы. Так, перманганат-ион должен окислять воду до кислорода, однако этого не происходит: водные растворы перманганата знакомы каждому.
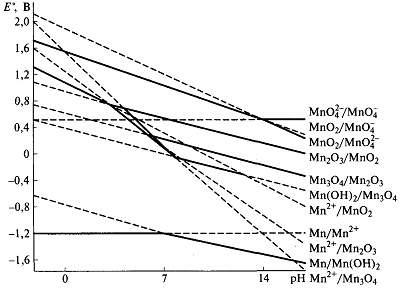
• Диаграмма Фроста отвечает стандартным условиям, т.е. 1 М растворам и
определенному значению рН: обычно 0 (для кислой среды) и 14 (для щелочной). При изменении кислотности среды меняется форма существования некоторых ионов и их устойчивость. Так, в щелочных растворах ион Мп2+
переходит в гидроксид Мп(ОН)2, и его вольт-эквивалент существенно понижается, а восстановительная активность возрастает.
Таким образом, наиболее характерной особенностью диаграммы служит глубокий минимум для состояния иона Мп2+. Такое высокоспиновое состояние марганца(П) отличается высокой стабильностью по сравнению с аналогичными состояниями технеция и рения. Низкие степени окисления в химии этих двух элементов представлены сравнительно немногочисленными комплексными соединениями, большинство из которых стабилизировано в кластерах со связями металл—металл. Незначительный наклон линии для технеция позволяет предсказать легкое взаимное превращение между его соединениями в различных степенях окисления.
В то же время, как видно из диаграммы Фроста, устойчивость соединений
технеция и рения в высоких степенях окисления заметно выше, чем соответствующих соединений марганца. Так, манганат Мп042- и перманганат Мп04- исключительно сильные окислители, тогда как пертехнетат Тс04- и перренат Re04 проявляют лишь слабые окислительные свойства. Зависимость стандартного электродного потенциала от кислотности среды
выражает диаграмма Пурбе.
По химической активности марганец значительно превосходит технеций и
рений. Он более электроположительный и по сравнению с соседними элементами по периоду: в электрохимическом ряду напряжений располагается между магнием и цинком. Марганец медленно выделяет водород из горячей воды, легко реагирует с разбавленными растворами
кислот: Мn + 2НС1 = МnС12 + Н2
Холодная концентрированная серная кислота на марганец не действует.
В сильнощелочных растворах марганец растворяется с выделением водорода:
Мn + 2NaOH + 2Н20 = Na2[Mn(OH)4] + Н2
Технеций и рений не растворяются в плавиковой и соляной кислотах, но взаимодействуют с кислотами-окислителями, бромной водой, пероксидом водорода с образованием технециевой НТс04 и рениевой HRe04 кислот:
ЗТс + 7HNO3(30 %) = ЗНТс04 + 7NO + 2Н20
2Re + 7Н202 = 2HRe04 + 6Н20
Все три металла образуют высшие оксиды М207. По свойствам оксид марганца(VII) существенно отличается от оксидов технеция(VII) и рения(VII). Марганцевый ангидрид Мп207 является одним из наиболее сильных окислителей, в то время как для оксидов Тс2О7 и Re207, образующихся непосредственно при горении металлов на воздухе, окислительные свойства практически не характерны.
Марганцевый ангидрид Мп207 представляет собой густую летучую гигроскопичную маслянистую жидкость темно-красного цвета, в отраженном свете кажущуюся зеленой с металлическим блеском. При температуре 5,9 °С она превращается в красные кристаллы. В безводных серной и фосфорной кислотах оксид марганца(VII) образует оливково-зеленые растворы:
Мп207 + 3H2S04 = 2Мп03+ + 3HS04- + Н30+
Вещество очень неустойчиво, оно разлагается со взрывом при сотрясении, в присутствии даже следовых количеств органических веществ.
При растворении в воде оксид марганца(VII) Мп207 образует темно-фиолетовый раствор марганцевой кислоты НМп04. Реакция протекает настолько быстро, что над сосудом часто возникает красно-фиолетовый туман, состоящий из капелек раствора НМnO4 и постепенно превращающийся в коричневые частицы пиролюзита.
Марганцевый ангидрид термодинамически нестабилен: он постепенно теряет кислород даже при температуре О "С. Марганцевый ангидрид окисляет большинство кислородсодержащих органических соединений, во многих случаях с воспламенением.
Высшие оксиды технеция и рения подобно марганцевому ангидриду чрезвычайно гигроскопичны во влажном воздухе и быстро поглощают воду, превращаясь в технециевую НТс04 и рениевую HRe04 кислоты, например:
Тс207(тв.) + Н20(ж.) = 2НТс04(тв.)
В отличие от Мп207 высшие оксиды технеция и рения являются слабыми
окислителями, при комнатной температуре не способными окислить боль
шинство органических веществ. Оксид Тс207 — более сильный окислитель, чем Re207. Он восстанавливается парами органических веществ. Таким образом, окислительная активность высших оксидов убывает вниз по группе.
Соли марганцевой кислоты — одни из важнейших неорганических окислителей, активные в твердой фазе и лабильные в растворе. С их помощью можно окислить многие органические и неорганические вещества.
Наиболее сильные окислительные свойства перманганат-ионы проявляют в кислотной среде, где они восстанавливаются до ионов Мп2+:
Мn04- + 8Н++ 5e = Мn2++ 4Н20
В нейтральной и слабощелочной среде перманганат-ионы восстанавливаются до диоксида марганца, выпадающего из раствора в виде бурого осадка: Мп04- + 2Н20 + 3е = Мn02 + 40Н-
в сильнощелочной среде (рН > 12,5) образуются изумрудно-зеленые манганат-ионы, устойчивые при рН > 14: Мn04- + e = Мп042-
При действии на подкисленный раствор перманганата калия разных восстановителей происходит его обесцвечивание:
10FeSO4 + 2KMn04 + 8H2S04 = 5Fe2(S04)3 + 2MnS04 + K2S04 + 8Н20
Для технеция(VII) и рения(VII) известны соединения, аналогичные соединениям марганца, однако в отличие от перманганатов они являются слабыми окислителями. Большие атомные радиусы обусловливают существование оксоанионов с координационными числами 5 и 6, напоминающих соответствующие периодаты.
Технециевая и рениевая кислоты подобно марганцевой представляют собой сильные одноосновные кислоты.
В отличие от иона перманганата пертехнетаты и перренаты устойчивы в щелочных растворах и характеризуются слабыми окислительными свойствами. Так, при действии на их подкисленные растворы сероводорода выпадают черные осадки высших сульфидов:
2NaRe04 + H2S04 + 7H2S = Re2S7 + Na2S04 + 8H20
Окислительные свойства пертехнетатов и перренатов в водных растворах проявляются лишь в кислой среде под действием сильных восстановителей, например иодидов, солей олова(П), титана(Ш), гипофосфитов: 2KRe04 + 6KI + 16НС1 = 2K2[ReCl6] + 4КС1 + 3I2 + 8Н20
Дата добавления: 2015-08-11; просмотров: 4914;
