Тепловые эффекты и термохимические уравнения. Закон Гесса и его применение.
Раздел химической термодинамики, в котором изучают теплоты химических реакций и зависимость их от различных физико-химических параметров, теплоемкости и теплоты фазовых переходов, носит название термохимии.
Тепловые эффекты реакций определяют как экспериментально, так и с помощью термохимических расчетов. Следует отметить, что невозможно определить абсолютные значениявнутренней энергии и энтальпии. Однако для термохимических расчетов это несущественно, поскольку интересует энергетический эффект процесса, т.е. изменение состояния системы — изменение значений U и Н.
При экзотермических реакциях теплота выделяется , т.е. уменьшается энтальпия, или внутренняя энергия, системы, и значения DН и DU для них отрицательны. При эндотермических реакциях теплота поглощается , т.е. Н и U системы возрастают, а DН и DU имеют положительные значения. Для того чтобы можно было сравнить энергетические эффекты различных процессов, термохимические расчеты обычно относят к 1моль вещества и условиям, принятым за стандартные. За стандартные принимают давление 101 325 Па и температуру чаще всего 25°С (298,15 К). Стандартные тепловые эффекты принято обозначать DH°298 (DU°298).
Тепловой эффект химической реакции, протекающей при постоянном давлении, не зависит от пути процесса, а определяется лишь начальным и конечным состоянием системы. Это формулировказакона Гесса, из которого вытекают два следствия:
Следствие 1. В стандартных условиях (ст.у.): P = 101325 Па, T=298,15 К (или 25oС), - тепловой эффект получения одного моля данного соединения из исходных простых веществ есть величина постоянная, называется стандартной теплотой образования (обозначается ΔHof,298 ) и приводится в справочных таблицах. Очевидно, что энтальпия образования простого вещества из этого же простого вещества в ст.у. равна 0.
Следствие 2. Тепловой эффект реакции при данной температуре равен сумме теплот образования продуктов реакции (п.р.) за вычетом суммы теплот образования исходных веществ, т.е. реагентов (если все указанные ΔHf определены при одной и той же T). Для ст.у. это запишется следующим образом: 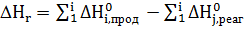 с учетом стехиометрических коэффициентов.
с учетом стехиометрических коэффициентов.
Дата добавления: 2015-08-11; просмотров: 1449;
