II закон Фарадея
При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на электродах, пропорциональны их эквивалентным массам:
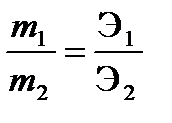 ,
,
где m1 и m2 – массы веществ 1 и 2,Э1 и Э2, г/моль – эквивалентные массы веществ 1 и 2.
На практике часто вследствие протекания параллельных окислительно- восстановительных процессов на электродах образуется меньше вещества, чем соответствует прошедшему через раствор электричеству, согласно I закону Фарадея.
Для характеристики потерь электричества при электролизе введено понятие «Выход по току». Выходом по току Втназывается выраженное в процентах отношение количества, фактически полученного продукта электролиза mфакт. к теоретически рассчитанному mтеор, соответствующему количеству прошедшего электричества: 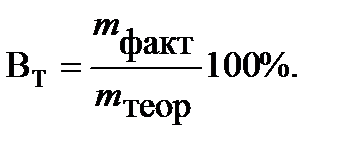
ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
ПРИМЕР 1. Увеличится или уменьшится масса цинковой пластинки при взаимодействии с растворами: а) AgNO3; б) NiSO4.
Решение: протекание окислительно-восстановительной реакции возможно, если потенциал окислителя больше потенциала восстановителя Еок-ля > Евосст-ля. В данной задаче восстановителем является цинк, а окислителями – катионы металла: в растворе нитрата серебра – Ag+ , в растворе хлорида никеля - Ni2+. Сравним значения стандартного потенциала цинка 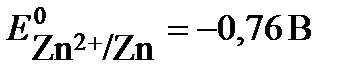 со значениями стандартных потенциалов никеля
со значениями стандартных потенциалов никеля 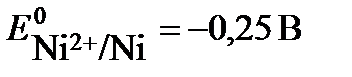 и серебра
и серебра 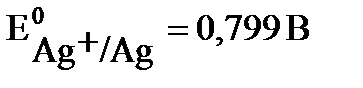 . Поскольку потенциал цинка имеет меньшее значение, чем потенциал никеля и серебра, то как более сильный восстановитель будет вытеснять никель и серебро из растворов их солей:
. Поскольку потенциал цинка имеет меньшее значение, чем потенциал никеля и серебра, то как более сильный восстановитель будет вытеснять никель и серебро из растворов их солей:
Zn + NiSO4 = ZnSO4 + Ni (1)
Zn + 2AgNO3 = Zn(NO3)2 + 2 Ag (2)
При погружении цинка в растворы NiSO4 и AgNO3, он будет растворяться, но одновременно на его поверхности будет осаждаться никель или серебро. Изменение массы цинковой пластины зависит от соотношения масс перешедшего в раствор цинка и осевшего на нем металла.
Согласно реакции (1) при растворении 1 моля цинка на поверхности осаждается 1 моль никеля. Сравним мольные массы металлов. Так как мольная масса никеля (58,9 г/моль) меньше, чем мольная масса цинка (65,4 г/моль), то масса цинковой пластины в растворе NiSO4 уменьшится.
Согласно реакции (2) при растворении 1 моля цинка осаждается 2 моль серебра, с мольной массой 107,9 г/моль, следовательно, масса цинковой пластинки в растворе AgNO3 увеличится.
ПРИМЕР 2. Вычислить значение электродного потенциала меди, опущенной в раствор соли с концентрацией ионов [Cu2+ ]= 0,001 моль/л.
Решение: вычисление электродного потенциала  производят по уравнению Нернста. Для медного электрода уравнение Нернста имеет вид:
производят по уравнению Нернста. Для медного электрода уравнение Нернста имеет вид: 
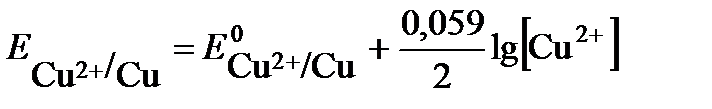
На поверхности меди, опущенной в раствор ее соли, устанавливается равновесие: Сu2+ + 2e ↔ Cu.
Подставляем в уравнение Нернста величину стандартного потенциала медного электрода, взятую из таблицы, и концентрацию ионов меди и рассчитываем

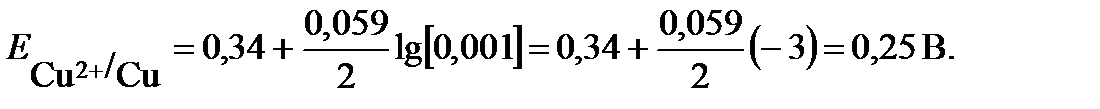
ПРИМЕР 3. Рассчитайте ЭДС свинцово-цинкового гальванического элемента при Т = 298К, в котором 
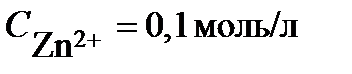 и
и 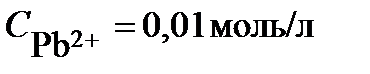 . Узнать знаки полюсов, написать уравнения равновесных электродных процессов, составить схему гальванического элемента. Рассмотреть направление процесса при замыкании цепи.
. Узнать знаки полюсов, написать уравнения равновесных электродных процессов, составить схему гальванического элемента. Рассмотреть направление процесса при замыкании цепи.
Решение: ЭДС гальванического элемента рассчитывают как разность равновесных потенциалов катода и анода: Е= Ек – Еа.
Для определения анода и катода рассчитаем по уравнению Нернста значения электродных потенциалов цинка и свинца, поскольку концентрации потенциалопределяющих ионов отличаются от 1 моль/л.
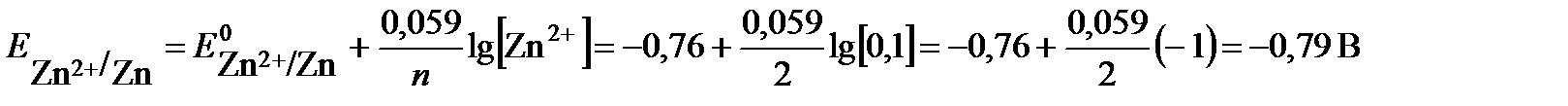
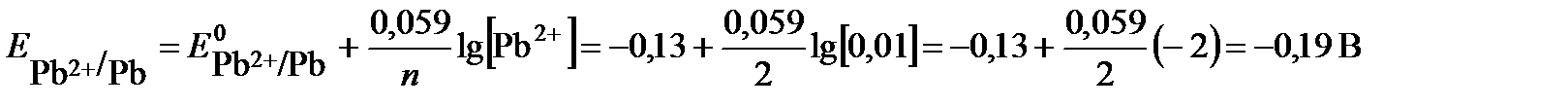
электрод с меньшим значением потенциала является анодом (цинковый электрод). На нем протекает реакция окисления:
(-) А: Zn – 2 e→ Zn2+
Электрод с большим значением потенциала является катодом (свинцовый электрод), на нем протекает реакция восстановления:
(+) К: Pb2+ + 2e → Pb
Уравнение токообразующей реакции: Zn + Pb2+ → Zn2+ + Pb.
Схема гальванического элемента: (-)Zn│Zn2+(0,1M)║Pb2+(0,01M)│Pb(+).
Рассчитываем ЭДС гальванического элемента
Е= Ек – Еа = 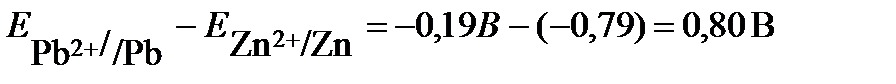
При замыкании цепи электроны во внешней цепи пойдут от отрицательного к положительному электроду - от цинка к свинцу.
ПРИМЕР 4. Для гальванического элемента
Pt│Cr3+(0,1 моль/л), Cr2+(0,01 моль/л)║0,01 моль/лН+│Н2(pH2 = 1 атм),Pt
Рассчитать ЭДС, написать уравнения электродных процессов, составить уравнение токообразующей реакции, указать знаки полюсов. По какому направлению движутся электроны во внешней цепи?
Решение: данный гальванический элемент составлен из окислительно-восстановительного и водородного электродов.
Потенциал окислительно-восстановительного электрода рассчитываем по уравнению Нернста: 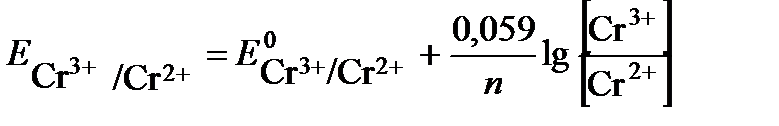
Стандартный потенциал пары Сr3+/Cr2+ 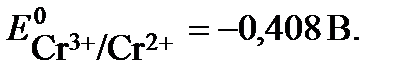 . Подставив данные условия задачи, рассчитаем потенциал окислительно-восстановительного электрода:
. Подставив данные условия задачи, рассчитаем потенциал окислительно-восстановительного электрода: 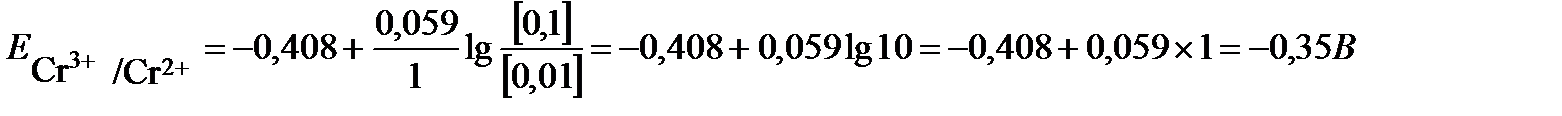 .
.
Второй электрод данного гальванического элемента является водородным электродом. Потенциал газового водородного электрода, согласно уравнению Нернста, зависит от концентрации (активности) ионов водорода и давления газа водорода в растворе:
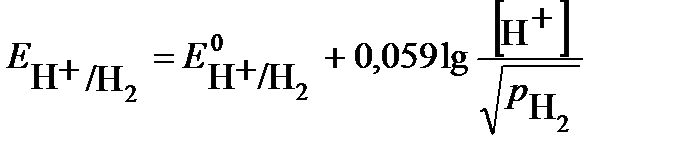 . Учитывая, что потенциал стандартного водородного электрода
. Учитывая, что потенциал стандартного водородного электрода 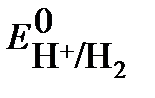 равен нулю, а давление водорода по условию задачи 1 атм., получим:
равен нулю, а давление водорода по условию задачи 1 атм., получим: 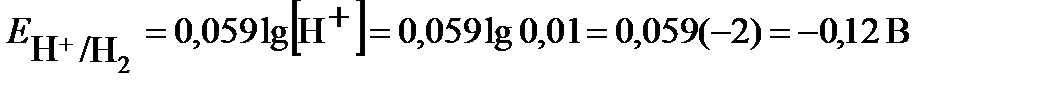 .
.
Определяем катод и анод. Поскольку окислительно-восстановительный электрод имеет меньший потенциал, то в гальваническом элементе он будет играть роль анода (отрицательный полюс), а водородный электрод – катода (положительный полюс). После замыкания цепи на первом электроде будет протекать анодный процесс окисления, на втором катодный процесс – восстановления:
На аноде Cr2+ - e → Cr3+
На катоде 2 Н+ +2е → Н2.
Суммарная токообразующая реакция описывается уравнением
2 Cr2+ + 2 Н+ → 2 Cr3+ + Н2
Электроны при замыкании внешней цепи будут двигаться от отрицательного полюса к положительному - от хромового окислительно-восстановительного электрода к водородному.
ЭДС данного элемента 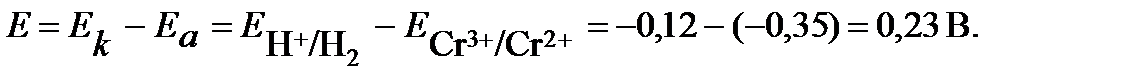
ПРИМЕР 5. Какие процессы протекают на электродах цинкового концентрационного гальванического элемента, если у одного из электродов концентрация (активность) ионов цинка Zn2+ равна 1 моль/л, у другого – 0,0001 моль/л? Какова ЭДС этого элемента?
Решение: Концентрационный гальванический элемент состоит из одинаковых электродов, погруженных в растворы своих солей различной концентрации. Определим потенциалы обоих электродов. Так как концентрация (активность) ионов цинка у первого электрода равна 1 моль/л, то потенциал его будет равен стандартному потенциалу цинкового электрода: 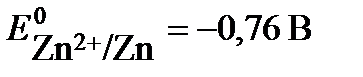 .
.
Потенциал второго электрода рассчитаем по уравнению Нернста:
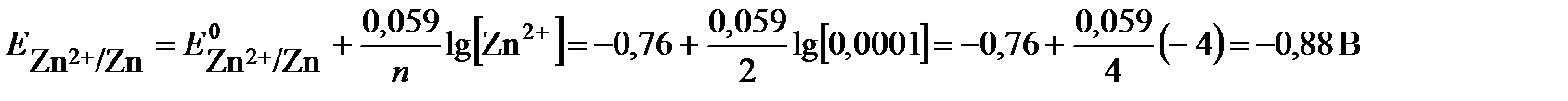 Второй электрод, имеющий меньший потенциал, будет анодом, на нем протекает реакция окисления: Zn -2 e→Zn2+.
Второй электрод, имеющий меньший потенциал, будет анодом, на нем протекает реакция окисления: Zn -2 e→Zn2+.
Первый электрод является катодом, на нем после замыкания цепи протекает реакция восстановления Zn2+ + 2e→Zn.
Токообразующая реакция в гальваническом элементе будет иметь вид
Zn + Zn2+→ Zn + Zn2+
Рассчитываем ЭДС элемента: Е = Ек-Еа = - 0,76 –(-0,88) = 0,12 В
Данный гальванический элемент можно отобразить схемой:
(-) Zn│Zn2+(0,0001 моль/л)║Zn2+(1 моль/л)│Zn(+)
ПРИМЕР 6. Константа равновесия реакции, протекающей в гальваническом элементе (-)Zn│Zn2+║Cd2+│Cd(+), равна 1,597•1012. Определите электродный потенциал кадмия, если электродный потенциал цинка 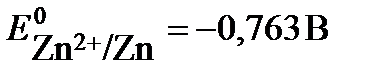 .
.
Решение: в данном гальваническом элементе протекает реакция
Zn + Cd2+ = Zn2+ + Cd. Между константой равновесия реакции, протекающей в гальваническом элементе и ЭДС элемента, существует зависимость: 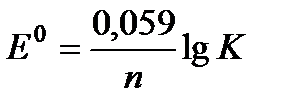 .
.
Для данного элемента 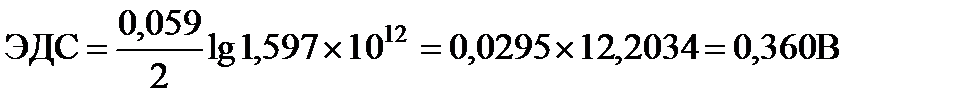 . В тоже время,
. В тоже время, 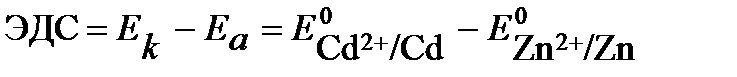 .
.
Отсюда потенциал кадмиевого электрода составит 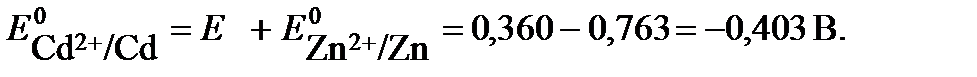
ПРИМЕР 7. Какие процессы будут протекать при электролизе водного раствора сульфата натрия с угольным анодом? Какие процессы изменятся, если угольный электрод заменить на медный?
Решение: в растворе сульфата натрия в электродных процессах могут участвовать ионы натрия Na+, SO42- и молекулы воды. Угольные электроды относятся к инертным.
На катоде возможны следующие процессы восстановления:
Na+ + e → Na 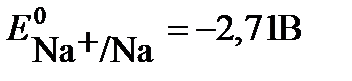
2H2O + 2e → H2 + 2 OH- 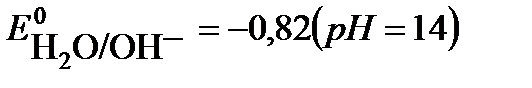
Потенциал восстановления молекул воды(-0,82В) дан для щелочного раствора, с учетом подщелачивания среды в ходе электролиза. Сравнивая потенциалы катодных реакций, видим, что потенциал восстановления воды наибольший, что соответствует их большей окислительной способности. Поэтому на катоде будет происходить восстановление молекул воды, сопровождающееся выделением водорода и образованием в катодном пространстве гидроксид ионов ОН-. Ионы натрия Na+, приходящие к катоду, будут накапливаться у электрода.
На аноде возможны следующие реакции:
2 SO42- - 2e → S2O82- 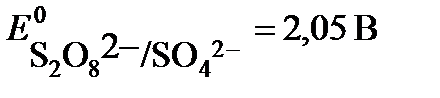
2 H2O - 4 e → 4H+ + O2  .
.
Окисление молекул воды идет при меньшем потенциале, следовательно, они обладают большей восстановительной способностью. Поэтому на аноде будет происходить окисление молекул воды с выделением кислорода и образованием кислой среды (ионов водорода Н+). Ионы SO42- будут накапливаться в анодном пространстве.
Таким образом, при электролизе раствора сульфата натрия с угольным инертным анодом в электродных процессах участвуют только молекулы воды. В близи катода ионы Na+ и OH- образуют раствор щелочи NaOH,а у анода ионы H+ и SO42- – раствор серной кислоты. Суммарная реакция электролиза выражается уравнением:
2 Na2SO4 + 6H2O = 2H2 + 4 NaOH + O2 + 2H2SO4.
у катода у анода
При замене инертного (угольного) анода на медный, на аноде становиться возможным протекание еще одной реакции окисления – растворение меди:
Cu – 2 e → Cu2+ 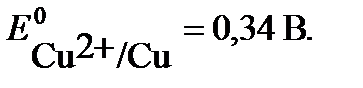
Этот процесс характеризуется меньшим значением потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе Na2SO4 с медным анодом на аноде пройдет окисление меди, а в анодном пространстве будет накапливаться сульфат меди CuSO4. Cуммарное уравнение реакции электролиза выразится уравнением:
Na2SO4 + 2H2O + Cu = H2 + 2 NaOH + CuSO4.
у катода у анода
ПРИМЕР 8. Составьте уравнение процессов, протекающих при электролизе водного раствора хлорида никеля NiCl2 с инертным анодом.
Решение: на катоде возможны следующие реакции:
Ni2+ + 2e → Ni 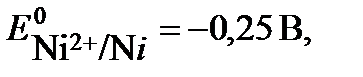
2H2O + 2e → H2 + 2 OH- 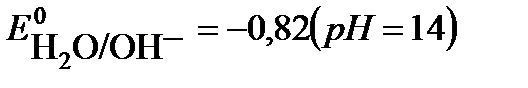 . Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов никеля.
. Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов никеля.
Большинство процессов при электролизе идет с перенапряжением, особенно образование газов (H2, O2 и др.). Пренебрежение величиной перенапряжения полуреакций может привести к неправильному определению природы электродного процесса.
Возможные анодные реакции:
2 Cl- - 2 e → Cl2 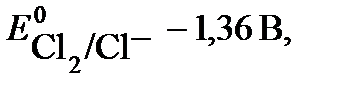
2H2O – 4 e 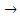 O2 + 4 H+
O2 + 4 H+ 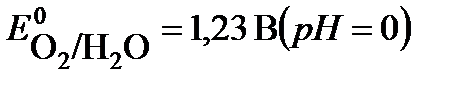
Потенциал окисления воды дан для кислого раствора (рН =0), с учетом подкисления раствора при электролизе.
Согласно величинам стандартных электродных потенциалов, на аноде должен выделятся кислород. В действительности на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода η0 = 1,17 В, что повышает потенциал окисления воды до 2,4 В.
Следовательно, электролиз раствора хлорида никеля протекает с образованием никеля и хлора: Ni2+ + 2Cl- = Ni + Cl2.
у катода у анода
ПРИМЕР 9. При электролизе водного раствора нитрата серебра AgNO3 с нерастворимым анодом в течение 25 мин, с силой тока 3 А на катоде выделилось 4,8 г серебра. Рассчитайте выход по току серебра. Какой процесс протекает на аноде?
Решение. При электролизе водного раствора нитрата серебра AgNO3 в случае применения нерастворимого анода (например, графитового) на электродах протекают процессы:
(-) К Ag+ + e → Ag 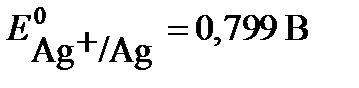 ,
,
2H2O + 2e → H2 + 2OH- 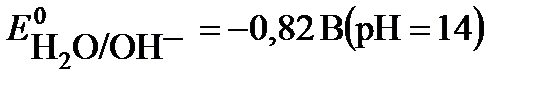
Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов серебра.
(+) A 2H2O – 4 e 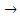 O2 + 4 H+
O2 + 4 H+ 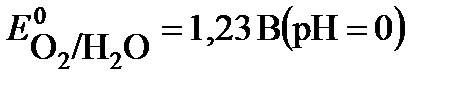 ,
,
анион NO3- не окисляем.
Суммарное уравнение электролиза нитрата серебра AgNO3: 2 AgNO3 + 2H2O = 2Ag + O2 + 4HNO3
у катода у анода
По первому закону Фарадея масса вещества, образующегося при электролизе , прямо пропорциональна количеству пропущенного через раствор электричества Q: 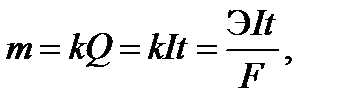
Эквивалентная масса cеребра ЭAg = 109 г/моль, постоянная Фарадея F = 26,8 А•ч/моль.
Определяем mтеор: 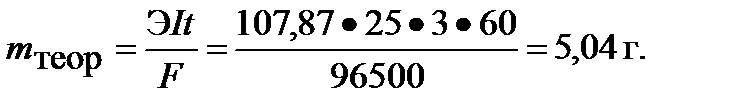 Выход по току
Выход по току 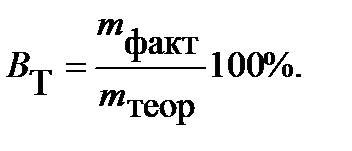
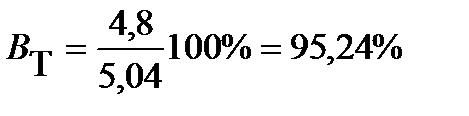 .
.
ПРИМЕР 10. Рассчитайте силу тока при электролизе раствора, если на катоде в течение 1 ч 40 мин выделилось 1,4 л водорода (н.у.).
Решение. Согласно закону Фарадея 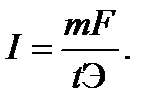 Так как количество водорода дано в объемных единицах, то отношение
Так как количество водорода дано в объемных единицах, то отношение 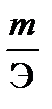 заменяем отношением
заменяем отношением 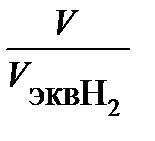 , где
, где 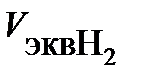 = 11,2 л/моль – эквивалентный объем водорода. Тогда сила тока
= 11,2 л/моль – эквивалентный объем водорода. Тогда сила тока 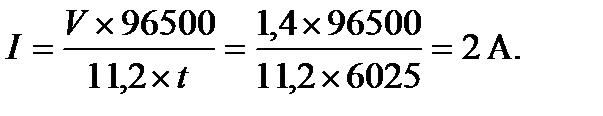
ПРИМЕР 11. Рассчитайте значение теоретического напряжения разложения водного раствора сульфата никеля NiSO4 при электролизе на платиновых электродах.
Решение: рассчитать теоретическое напряжения разложения электролита, это значит определить разность потенциалов анодного и катодного процессов, протекающих на электродах: Eн.р.= Еа – Ек .
Платиновые электроды относятся к инертным электродам. При электролизе раствора NiSO4 на катоде выделяется никель, а на аноде – кислород:
(-) К Ni2+ + 2e → Ni 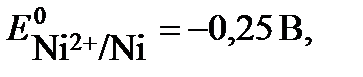
(+) A 2H2O – 4 e 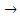 O2 + 4 H+
O2 + 4 H+ 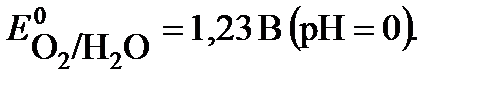
Суммарное уравнение электролиза: 2NiSO4 + 2H2O → 2Ni + O2 + 2H2SO4
Теоретическое напряжение разложения 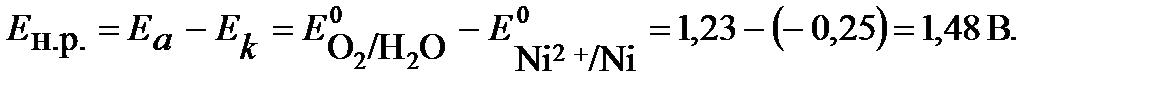
Практическое напряжение разложения выше теоретического за счет перенапряжения выделения продуктов электролиза.
ВОПРОСЫ И ЗАДАНИЯ
1. Какие из перечисленных ионов Al3+, V2+, Pb2+, H+, Cu2+могут быть восстановлены железом из водных растворов?
2. а) никелевая пластинка внесена в раствор соли трехвалентного хрома. Возможно ли растворение никеля и выделение хрома? б) хромовая пластина внесена в раствор соли никеля. Возможно ли растворение хрома и выделение никеля?
3. Возможно ли вытеснение хромом цинка из раствора его соли? Возможно ли вытеснение цинком хрома из раствора его соли?
4. Будет ли реагировать металлический цинк с растворами: а) NaCl; б) MgSO4; в) СuSO4; г) Hg(NO3)2? Написать уравнения протекающих реакций.
5. В 1 М растворы HCl, CuSO4, Pb(NO3)2, Al2(SO4)3, KNO3, NiSO4опускают по кусочку олова. В каком растворе олово будет растворяться?
6. Какие металлы будут выделяться, если кадмиевая пластинка опущена в раствор, содержащий одновременно MnSO4, NiSO4, NaCl, AgNO3cодинаковой концентрацией катионов?
7. Из каких солей металл может быть вытеснен никелем: Pb(NO3)2, Al2(SO4)3, CuSO4, AgNO3, ZnSO4?
8. Какие металлы будут выделяться на а) Fe- пластине; б) Ni- пластине, если они опущены в растворы солей с одинаковой концентрацией катионов: NaCl, MnSO4, CuSO4, ZnSO4, MgCl2, AgNO3?
9. Какие металлы будут выделяться, если марганцевая пластинка опущена в растворы солей с одинаковой концентрацией катионов: FeSO4, MgCl2, ZnSO4, Hg(NO3)2?
10. Никелевые пластинки опущены в растворы: Pb(NO3)2, MgSO4, NaCl, CuSO4, AlCl3, ZnCl2. С какими солями цинк будет реагировать? Напишите уравнения реакций в молекулярной и ионной форме.
11. В шесть пробирок налиты растворы: MgSO4, HgCl2, CuSO4, Al2(SO4)3, AgNO3, SnCl2. В каждую брошено по кусочку цинка. В каких пробирках произошли реакции? Выразите их молекулярными и ионными уравнениями.
12. Какие из перечисленных ниже взятых попарно веществ будут взаимодействовать друг с другом? Fe+HCl; Cu+ HCl; Hg+ AgNO3;
Zn+ MnSO4; Mg+ NiCl2. Выразите протекающие реакции молекулярными и ионными уравнениями.
13. Между какими из перечисленных ниже взятых попарно веществ пойдет реакция замещения? Ag+ HF; Cu+ HgCl2; Zn+ MgCl2; Sn+ HCl;
Hg+ HCl; Zn+ AgNO3.
14. Три свинцовых пластинки опустили в растворы: а) CuSO4; б) Zn(NO3)2;
в) HNO3(разб.). Что произойдет в каждом случае с массой пластинки? Ответ поясните с помощью химических реакций.
15. Три пластинки из железа погружали соответственно в растворы:
а) CuSO4; б) Pb(NO3)2; в) ZnSO4. Как изменится масса пластинок после взаимодействия их с растворами?
16. Увеличится или уменьшится масса цинковой пластинки при взаимодействии с растворами: а) CuSO4; б) Pb(NO3)2 ?
17. Увеличится или уменьшится масса железной пластинки после выдерживания ее в растворе: а) Na2SO4; б) NiSO4; в) AgNO3?
18. В два сосуда с голубым раствором медного купороса поместили: в первый цинковую пластинку, во второй – серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте молекулярные и ионные уравнения реакций.
19. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) AgNO3; б) ZnSO4; в) NiSO4?
20. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) Pb(NO3)2; б) MgSO4; в) CuSO4?
21. Составьте гальванический элемент, в котором железная и никелевая пластинки помещены в растворы своих солей. Напишите электродные реакции, уравнение токообразующей реакции, рассчитайте ЭДС и константу равновесия.
22. Составьте схему, напишите уравнения электродных процессов и рассчитайте ЭДС элемента, состоящего из серебряной и свинцовой пластин, погруженных в раствор собственных ионов с концентрацией (активностью) [Ag+]=[Pb2+]=1моль/л. Изменится ли ЭДС, если концентрация (активность) каждого иона уменьшится в 10 раз?
23. Составьте схему работы замкнутого гальванического элемента, образованного железом и свинцом, погруженных в 0,005 М растворы своих солей. Рассчитайте ЭДС, и Аmaxэтого элемента.
24. Рассчитайте ЭДС медно-свинцового элемента, в котором [Cu2+]=0,1 моль/л и [Pb2+]=0,01 моль/л. Напишите уравнения реакции и определите направление движения электронов во внешней цепи.
25. Рассчитайте ЭДС элемента, в котором возникает реакция:
Zn+ Sn2+= Zn2+ + Sn при [Zn2+]= 10-4 моль/л, [Sn2+]= 10-2 моль/л.
26. Рассчитайте ЭДС элемента, в котором возникает реакция
Сd+ Cu2+ = Cd2++ Cuпри [Cd2+]= 10-4 моль/л, [Cu2+]= 10-2 моль/л.
27. ЭДС гальванического элемента, образованного никелем, погруженным в раствор его соли с концентрацией ионов никеля 10-4 моль/л, и серебром, погруженным в раствор его соли, равна 1,108 В. Определите концентрацию ионов серебра в растворе его соли.
28. Вычислите ЭДС концентрационного элемента, состоящего из цинковых электродов, опущенных в раствор сульфата цинка ZnSO4с концентрацией 2•10-2 и 3,2•10-3 моль/л.
29. Составьте схему концентрационного элемента с концентрацией ионов цинка, у одного из электродов [Zn2+] = 10-2 моль/л, а у другого [Zn2+] =
= 1•10-6 моль/л. Укажите, какой из этих электродов будет катодом, какой – анодом. Рассчитайте ЭДС элемента.
30. Какие процессы имеют место у магниевого концентрационного гальванического элемента, если концентрация (активность) ионов магния у одного электрода [Mg2+] = 1 моль/л, а у другого - [Mg2+] = 0,001 моль/л. По какому направлению движутся электроны во внешней цепи? Какое значение ЭДС этого элемента?
31. Составьте схему концентрационного гальванического элемента при [Ag+] = = 10-2 моль/л у одного электрода и [Ag+] = 10-4 моль/л – у другого. Укажите, какой из электродов будет анодом, какой – катодом. Рассчитайте ЭДС этого элемента.
32. Имеется гальванический элемент
Co│ [Co2+]=1 моль/л║[Ni2+]=Xмоль/л│ Ni. При какой концентрации ионов никеля (Xмоль/л) электродный потенциал никеля будет равен электродному потенциалу кобальта?
33. Какова ЭДС концентрационного элемента, состоящего из серебряных электродов, находящихся в 0,1 М и 0,001 М растворах нитрата серебра?
34. Рассчитайте ЭДС концентрационного элемента, состоящего из двух водородных электродов, погруженных в растворы с рН 2 и 4.
35. ЭДС элемента (-) Fe│[Fe+2] =0.1 моль/л║[Ag+] = Xмоль/л│Ag(+)равна 1,152 В. Вычислите Х.
36. Определите концентрацию ионов Cu2+ в растворе, если при 298 К ЭДС элемента, в котором протекает реакция Zn+ Cu2+= Zn2++ Cu, равна 1,16 В и [Zn2+] = 10-2 моль/л.
37. ЭДС гальванического элемента, составленного из двух водородных электродов, равна 0,271 В. Чему равен рН раствора, в который погружен анод, если катод погружен в раствор с рН=3?
38. Вычислите ЭДС и определите направление движения электронов во внешней цепи гальванического элемента:
а) Fe│Fe2+(1 моль/л)║Ag+(0,01 моль/л)│Ag;
б) Fe│Fe2+(0,1 моль/л)║Ag+(0,01 моль/л)│Ag;
в) Fe│Fe2+ (0,01 моль/л)║Fe2+(1 моль/л)│Fe;
г) Al│Al3+ (0,1 моль/л)║Al3+(0,01 моль/л)│Al;
д) Zn│Zn2+(1 моль/л)║Fe2+(0,01 моль/л)│Fe;
е) Сu│Cu2+(0,1 моль/л)║Ag+(0,001 моль/л)│Ag;
39. Гальваническая цепь составлена железом, погруженным в раствор его соли с концентрацией ионов Fe2+,равной 0,001 моль/л, и медью, погруженной в раствор ее соли. Какой концентрации должен быть раствор соли меди, чтобы ЭДС элемента была равной 0,85 В?
40. Какой из электродов отрицательный и какой положительный в концентрационном элементе, образованном алюминиевыми электродами, при концентрации (активности) ионов Al3+в одном 0,01 моль/л, в другом – 0,1 моль/л. Рассчитайте ЭДС элемента.
41. Гальванический элемент составлен из стандартного цинкового электрода и хромового электрода, погруженного в раствор, содержащий ионы Cr3+. При какой концентрации ионов Cr3+ЭДС этого элемента будет равна нулю?
42. Составьте схему, напишите реакции электродных процессов и суммарной реакции и рассчитайте ЭДС элемента, у которого один цинковый электрод с концентрацией (активностью) ионов цинка Zn2+10-2 моль/л, а второй – водородный при стандартном давлении водорода и рН = 2.
43. Вычислите ЭДС гальванического элемента, образованного электродами Sn│Sn2+при [Sn2+]= 0,5 моль/л, Ag│Ag+ при [Ag+] = 0,01 моль/л и сравните с ЭДС гальванического элемента, образованного стандартными электродами тех же металлов. Напишите уравнения реакций, протекающих на катоде и аноде.
44. Составьте схему, напишите уравнения электродных процессов и суммарной реакции и рассчитайте ЭДС элемента, составленного из электродов: Pt│Fe3+,Fe2+ и Pt│Cr3+Cr2+. Концентрация (активность) всех ионов cоставляет 0,1 моль/л.
45. Вычислите ЭДС гальванического элемента, образованного электродами Mg│Mg2+и Zn│Zn2+при концентрации ионов [Mg2+]=0,1 моль/л, [Zn2+] = 2моль/л. Сравните значение ЭДС с ЭДС элемента, образованного стандартными электродами тех же металлов. Напишите реакции, протекающие на катоде и аноде.
46. Составьте схему, напишите уравнения электродных процессов рассчитайте ЭДС элемента, состоящего из медной и кадмиевой пластин, погруженных в раствор собственных ионов с концентрацией (активностью) 0,1 моль/л. Изменится ли ЭДС, если концентрация (активность) каждого иона возрастет в 10 раз?
47. Даны два гальванических элемента: а) Pt│Cr3+,Cr2+║Sn2+,Sn4+│Pt, б) Pt│Sn2+,Sn4+║Fe3+,Fe2+│Pt. На основании стандартных электродных потенциалов определите, в каком элементе будет осуществляться окисление ионов Sn2+. Рассчитайте константу равновесия для реакции, протекающей в этом элементе.
48. Константа равновесия реакции, протекающей в элементе Zn│Zn2+║Fe3+,Fe2+│Pt, составляет 1•1053 (Т=298К). Определите значение электродного потенциала окислительно-восстановительного электрода 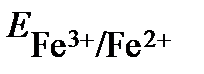 , если
, если 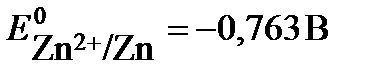 . Составьте уравнения электродных и токообразующей реакции, укажите знаки электродов. Запишите математическое выражение Кс и уравнение токообразующей реакции.
. Составьте уравнения электродных и токообразующей реакции, укажите знаки электродов. Запишите математическое выражение Кс и уравнение токообразующей реакции.
49. Составьте схему элемента, в котором протекает реакция
SnCl2+ HgCl2= SnCl4+ Hg. Определите катод и анод и напишите протекающие на них реакции. Рассчитайте ЭДС элемента.
50. Константа равновесия реакции, протекающей в элементе
Pt│Sn4+,Sn2+║Fe3+,Fe2+│Pt, составляет 1•1021. Определите 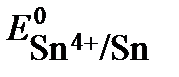 , если
, если 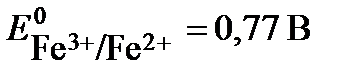 . Напишите уравнение токообразующей реакции, укажите знаки полюсов в элементе, математическое выражение Кс.
. Напишите уравнение токообразующей реакции, укажите знаки полюсов в элементе, математическое выражение Кс.
51. Имеем гальванический элемент Pb│Pb2+(1моль/л)║Cu2+(10-2моль/л)│Cu. напишите катодный и анодный процессы, уравнение токообразующей реакции. Рассчитайте ЭДС этого элемента.
52. Константа равновесия реакции, протекающей в элементе Ni + 2Fe3+ = Ni2+ + + 2Fe2+, составляет 1035(Т=298К). Определите 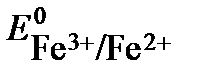 , если
, если 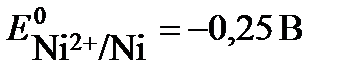 . Напишите реакции на электродах и составьте схему гальванического элемента.
. Напишите реакции на электродах и составьте схему гальванического элемента.
53. Вычислите ЭДС гальванического элемента, составленного из кадмиевой и медной пластинок, опущенных в 0,1 М растворы их солей. Запишите схему элемента, напишите уравнения реакций на аноде и катоде, а также токообразующей реакции. Укажите направление перемещения электронов во внешней цепи.
54. Рассчитайте ЭДС элемента, в котором протекает реакция
Fe + 2Ag+ = Fe2+ + 2 Ag при [Fe2+] = 10-2 моль/л, [Ag+] = 10-3 моль/л.
55. Гальванический элемент состоит из серебряного электрода, погруженного в раствор 1 M AgNO3 ,и стандартного водородного электрода. Напишите уравнения электродных процессов и суммарной реакции, протекающей при работе элемента. Какое значение имеет ЭДС?
56. Определите концентрацию (активность ) ионов Cu2+ в растворе, если ЭДС элемента, в котором протекает реакция Zn + Cu2+ = Zn2+ + Cu,равна 1,16 В и [Zn2+]=10-2 моль/л.
57. Составьте схему работы гальванического элемента, образованного железом и свинцом, погруженными в 0,005 М растворы их солей. Рассчитайте ЭДС этого элемента.
58. Составьте схему электролиза водных растворов H2SO4 и CuCl2 с платиновыми электродами.
59. Какие процессы протекают на инертных электродах и какие вещества выделяются на электродах при электролизе: а) CuCl2; б) AgNO3;
в) Zn(NO3)2; г) MgCl2; д) K2SO4?
60. Напишите уравнения реакций, протекающих на платиновых инертных электродах при электролизе:
а) раствора хлористого кальция в воде;
б) расплава хлористого кальция;
в) раствора сульфата магния в воде;
г) расплава сульфата магния;
д) водных растворов Сr2(SO4)3, AgNO3.
61. Одинаковы ли продукты электролиза водных растворов NaCl и Na2SO4 на инертных электродах? Какие продукты образуются в прикатодном и прианодном пространствах, если электролиз проводить с диафрагмой?
62. Какое вещество и в каком количестве выделится на графитовом аноде при электролизе раствора CuCl2, если на катоде выделилось 1,589 г меди?
63. Составьте схему процессов, происходящих на медных электродах, при электролизе водного раствора KNO3.
64. Напишите уравнения электродных процессов, протекающих при электролизе водных растворов BaCl2 и Pb(NO3)2 с угольными электродами.
65. Какие процессы протекают на платиновых электродах и какие продукты получаются при электролизе раствора K2SO4 на электродах:
а) угольном;
б) никелевом?
66. Одинаковы ли будут продукты электролиза растворов солей NaI и CaI2 на графитовых электродах? Ответ обосновать соответствующими уравнениями реакций.
67. Напишите уравнения реакций на катоде и аноде водного раствора MnSO4, если электроды: а) угольные; б) марганцевые.
68. Составьте уравнения процессов, протекающих при электролизе расплавов NaOH и NiCl2 с инертными электродами.
69. Напишите уравнения реакций у катода и анода при электролизе водного раствора NiCl2, если применен анод: а) угольный; б) никелевый.
70. Составьте схему электролиза раствора нитрата свинца на угольных электродах. Что произойдет при замене электродов на свинцовые?
71. Через последовательно соединенные электролитические ванны с платиновыми электродами пропускали электрический ток. В первой ванне был раствор кислоты, во второй – раствор AgNO3 и в третьей – раствор СuCl2. Какие продукты и в каких количествах выделяются на электродах в каждой из трех ванн, если в первой ванне на катоде получено 1 мг водорода?
72. Ток, силой 2,5 А, проходит последовательно через растворы FeCl2 и FeCl3 в течение 30 мин. Одинаковое ли количество железа и хлора выделится на электродах? Ответ подтвердите расчетом. Принять выход по току Вт процессов на аноде и катоде равным 100%
73. Как электролитически получить LiOH из соли лития? Какое количество электричества необходимо для получения 1 т LiOH? Составьте схемы электродных процессов.
74. Составьте схемы электролиза водных растворов солей а) CuSO4 на медных электродах; б) NiSO4 на никелевых электродах. Что произойдет при замене металлических электродов угольными?
75. Напишите уравнения реакций, протекающих на графитовых электродах при электролизе: а) расплава хлорида магния, б) раствора хлорида магния. Сколько времени необходимо вести электролиз при силе тока 2 А, чтобы на катоде выделилось 2,43 г вещества для реакций а) и б)?
76. Через растворы FeCl2, CuCl2 и MgSO4 последовательно пропускали ток в 2 А в течение 20 мин. Какие вещества и в каком количестве выделилось в каждом случае на катоде и аноде.
77. Как долго надо пропускать ток, силой 2,5 А, через расплавленный хлорид свинца, чтобы на катоде выделилось 20 г металла? Составьте схему электролиза на угольных электродах.
78. Вычислите выход по току, зная, что после пропускания тока 0,5 А через раствор ZnSO4 в течение 30 мин. масса катода увеличилась на 0,25 г. Дать схему электролиза на цинковых электродах.
79. Через раствор сульфата железа (II) пропускали ток силой 13,4 А в течение 1 ч. Определите количество железа, которое выделилось на катоде, если выход по току железа был равен 70%. Напишите уравнения реакций, протекающих на графитовых электродах.
80. Какое вещество и в каком количестве выделится на графитовом аноде при электролизе водного раствора CuSO4, если на катоде выделится 1,589 г меди? (Вт=100%).
81. Электролиз раствора K2SO4 проводили с медными электродами при силе тока 2,68 А в течение 1 часа. Составьте уравнения процессов, происходящих на электродах, вычислите объем выделяющихся на электродах веществ при н.у.
82. При электролизе сульфата меди на угольном аноде выделилось 560 мл кислорода, измеренного при н.у. Сколько граммов выделилось на катоде.
83. Для выделения 1,75 г некоторого металла из раствора его соли потребовалось пропустить ток, силой 1,8 А, в течение 1,5 ч. Вычислите эквивалент металла.
84. Через раствор сульфата кадмия пропущено 25 А•час электричества. При этом на катоде выделилось 42,5 г кадмия. Напишите уравнения реакций на электродах. Рассчитайте выход по току (Вт) кадмия.
85. Электролиз раствора сульфата цинка проводили с нерастворимым анодом в течение 6,7 ч, в результате чего выделилось 5,6 л кислорода, измеренного при н.у. Вычислите силу тока и количество осажденного цинка, если выход по току составил 70%
86. Через раствор хлорида железа (II) пропускали ток, силой 3 А, в течение 10 мин, через раствор хлорида железа (III) – ток, силой 5 А, в течение 6 мин. Одинаковое или разное количество железа выделилось на катодах при Вт = 100%? Какой газ и в каком количестве выделился на графитовых анодах?
87. Напишите уравнения реакций, протекающих на электродах при электролизе водного раствора сульфата никеля. Рассмотрите при этом: а) никелевые электроды; б) нерастворимые электроды. Какой должна быть сила тока, чтобы за 10 ч на катоде выделилось 47 г никеля при выходе по току 80%?
88. Какое вещество и в каком количестве выделилось на катоде при электролизе раствора SnCl2, если на аноде выделилось 1,12 л хлора (н.у.).
89. Деталь была оцинкована за 1 час 40 мин. Электролит – раствор ZnSO4. Масса покрытия (Zn) составляет 7,84 г. Выход по току – 72%. Чему была равна сила тока?
90. Для получения 1 м3 хлора (н.у.) при электролизе водного раствора хлорида натрия через раствор пропущено 2500 А•час электричества. Вычислите выход по току. Напишите схему электролиза.
91. Ток проходит последовательно через растворы сульфата меди и хлорида олова (II). Через некоторое время в первом выделилось 3,2 г меди. Какое количество олова выделилось за это время из второго раствора при выходе по току 100%? Напишите схемы электролиза этих солей.
92. Сколько граммов H2SO4 образуется около нерастворимого анода при электролизе раствора Na2SO4, если на аноде выделяется 1,12 л кислорода (н.у.)? Вычислите массу вещества, выделившегося на катоде.
93. Ток 20 А в течение 30 мин. пропускали через расплав хлорида свинца. Найти массу выделившегося свинца и объем образовавшегося газа (н.у.). Составить схему электролиза на платиновых, инертных электродах.
94. Ток, силой 3 А, в течение 1 ч пропускали через раствор нитрата серебра. Сколько граммов серебра выделилось на катоде?
95. В двух электролизерах с графитовыми электродами происходит электролиз: а) раствора едкого натра; б) расплава едкого натра. Напишите уравнения реакций на электродах. Рассчитайте массу веществ, выделившихся на катоде, при прохождении 26,8 А•час электричества через электролизер (Вт =100%).
96. При электролизе MgSO4 и CuSO4 в электролизерах, соединенных последовательно, на катоде одного из электролизеров выделилось 0,2 г водорода. Сколько граммов вещества выделилось на других электродах. Электроды угольные.
97. При прохождении через раствор соли трехвалентного металла тока, силой 1,5 А, в течение 30 мин на катоде выделилось 1,071 г металла. Определите атомную массу и назовите металл.
98. Какие вещества и в каком количестве выделились на аноде и катоде при электролизе раствора MgCl2 с силой тока 2 А в течение 0,5 час? Анод изготовлен из инертного материала.
99. Какие процессы идут на графитовых электродах при электролизе раствора KOH? Сколько граммов вещества выделится на электродах при прохождении через раствор тока силой 6,7 А в течение 1 ч?
100. Вычислите выход по току, зная, что после пропускания тока 0,5 А через раствор ZnSO4 в течение 30 мин масса катода увеличилась на 0,25 г. Дайте схему электролиза на графитовых электродах.
Дата добавления: 2015-07-22; просмотров: 10047;
