Получение марганца
Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита: 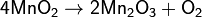 ;
; 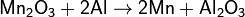
Мn6+ диспропорционирует на MnO2 и MeMnO4.
Mn3+ диспропорционирует на Mn2+ и MnO2 (тв.)
Оксиды:
Известны оксиды марганца, в которых он находится в степенях окисления +2, +3, +4, +7, а также несколько смешанных, например Мn304. При увеличении степени окисления возрастает ковалентный характер связи Мn—О, происходит ослабление основных и усиление кислотных свойств, повышение окислительной активности. Так, оксид марганца(2) проявляет основные и преобладающие восстановительные свойства, а высший оксид марганца имеет кис
лотный характер. У него ярко выражены окислительные свойства. Оксиды марганца в промежуточных степенях окисления амфотерные и легко восстанавливаются до Mn(II), проявляя свойства сильных окислителей.
Оксид марганца(2). Низший оксид МnО представляет собой серо-зеленый кристаллический порошок со структурой NaCl. Он встречается в природе в виде минерала манганозита. Его
реакционная способность зависит от размера зерен. Высокодисперсная форма оксида, образующаяся при низкотемпературном разложении (420 —450 °С) карбоната, оксалата или ацетата марганца(П), обладает значительной химической активностью — воспламеняется на воздухе. Ее прокаливание в инертной атмосфере приводит к укрупнению зерен и ослаблению химической активности. Для получения фазы стехиометрического состава проводят восстановление оксидов Мn304 и Мn02 водородом при высоких температурах. Низший оксид марганца может быть также получен при взаимодействии марганца
с углекислым газом при температуре 300 "С, восстановлении или прокаливании других оксидов марганца, а также при обезвоживании гидроксида Мn(ОН)2 в восстановительной атмосфере при 800 °С.
Оксид марганца(2) обладает преимущественно основным характером. Он легко растворяется в кислотах с образованием солей двухвалентного марганца. Слабая амфотерность проявляется лишь при
длительном кипячении с концентрированными растворами щелочей:
МпО + 20Н- + Н20= 4[Мn(ОН)4]2- Сплавление с гидроксидом натрия приводит к окислению марганца: МnО + 2NaOH = Na2Mn03 + H2
Оксид марганца(2) практически не восстанавливается водородом, зато реагирует с активными металлами. Реакция с натрием протекает уже при комнатной температуре, а для проведения алюмотермии требуется инициирование зажигательной смесью. В качестве восстановителя могут быть использованы также углерод или угарный газ.
Оксид марганца(2) является сильным восстановителем — при повышенных температурах он реагирует даже с таким слабым окислителем, как оксид углерода(4).
Оксид марганца(3). Оксид Мn203 представляет собой бурый
порошок, при нагревании разлагающийся. при хранении на воздухе он медленно окисляется до оксида марганца(4), а в эвтектическом расплаве NaOH —КОН (227 °С) кислород переводит его в
манганат(5). Оксид марганца(3) с водой не взаимодействует, а в кислой среде диспропорционирует.
Подобно низшему оксиду марганца он обладает преимущественно основным характером, но при определенных условиях проявляет некоторые признаки амфотерности. Так, при длительном кипячении с растворами щелочей образуются анионные гексагидроксоманганаты(3) [Мn(ОН)6]3-, которые существуют только в сильнощелочной среде. Окислительные свойства Мn203 проявляет при кипячении с концентрированной соляной кислотой.
Оксид марганца(4).Для марганца это наиболее часто встречающийся в природе минерал пиролюзит Мn02. Среди многочисленных реакций образования Мn02 только некоторые предпочтительны благодаря легкости проведения и воспроизводимости. К ним относятся окисление соединений марганца(2) растворами хлоратов, перманга-
натов, персульфатов, хлором и озоном, восстановление перманганатов действием пероксида водорода, соляной кислоты, сернистого газа, сульфитов, спиртов, солями марганца(2). Большая часть диоксида марганца выделяется в виде бурого осадка, однако часть его остается в виде коллоидного раствора. Диоксид марганца как соединение промежуточной степени окисления проявляет окислительные и восстановительные свойства. Для него более характерно поведение окислителя. При нагревании происходит внутримолекулярная окислительно-восстановительная реакция, сопровождающаяся выделением кислорода и постепенным понижением степени окисления марганца с последовательным образованием разных оксидов. С сухим сероводородом реакция протекает очень быстро уже при комнатной температуре. При пропускании сероводорода через водную суспензию Мn02 образуется белесый осадок, состоящий из смеси сульфида марганца(2) и серы; в растворе присутствуют ионы S04- и S202-.
Окислительные свойства диоксида марганца сильнее всего проявляются в сильнокислой среде. При обработке диоксида марганца холодной концентрированной соляной кислотой остается темный раствор, содержащий комплексную кислоту Н2[МпС16], а возможно, и невыделенный в индивидуальном виде тетрахлорид МnС14. Постепенно раствор светлеет вследствие восстановления хлоридных
комплексов [МnС16]2--» [МnС16]3- -> Mn2+ + 6C1- и выделения хлора.
В азотной и разбавленной серной кислотах Мn02 нерастворим, лишь при длительном хранении его под раствором кислоты наблюдается постепенное выделение кислорода вследствие окисления воды. Взаимодействие диоксида Мn02 с щелочами протекает лишь в концентрированных растворах и расплавах. В зависимости от температуры реакции, соотношения реагентов, наличия или отсутствия окислителей, например кислорода воздуха, образуются анионные оксоманганаты, содержащие марганец в разных степенях окисления от +3 до +6. Например, при взаимодействии диоксида марганца с горячим концентрированным раствором гидроксида калия в инертной атмосфере сначала образуется зеленый раствор манганата(4), который затем переходит в темно-синий раствор, содержащий эквимолярные количества манганата(5) и манганата(3). При проведении реакции на воздухе при температуре 350 — 450 °С образуется манганат(6), при температуре 600 —800 °С — манганат(5).
Дата добавления: 2015-08-11; просмотров: 2514;
