Комплексы. Для палладия и платины также известны карбонильные кластеры, построенные из треугольников [М3], расположенных параллельно друг другу и соединенных связями
Для палладия и платины также известны карбонильные кластеры, построенные из треугольников [М3], расположенных параллельно друг другу и соединенных связями металл—металл. Поскольку энергия расщепления значительн возрастает в ряду Ni — Pd — Pt, палладий и платина образуют исключительно плоскоквадратные комплексы даже с лигандами слабого поля. Комплексы палладия(П) и платины(П) с любыми лигандами подобно комплексам никеля(П) с лигандами сильного поля низкоспиновые, диамагнитные и имеют плоскоквадратную геометрию, что объясняется существенным увеличением энергии расщепления от Ni(II) к Pt(II). Важным свойством этих комплексов является их кинетическая инертность, особенно ярко выраженная у платины. Это позволило тщательно изучить механизм замещения в плоскоквадратных комплексах платины(П) и выявить факторы, влияющие на направление протекания про
цесса.
Из раствора, полученного растворением палладия в азотной кислоте, кристаллизуются коричневые кристаллы нитрата Pd(N03)2(H20)2, имеющие молекулярное строение. Азотный ангидрид отнимает от него воду, переводя в безводную соль Pd(N03)2, содержащую мостиковые нитратные группы. В концентрированных растворах нитрата в координационную сферу палладия входит анион NO3-, при разбавлении раствора происходит гидролиз, заканчивающийся выпадением студенистого желтовато-коричневого осадка гидратированного оксида PdO • nН20. При хранении он темнеет, постепенно теряя воду, однако полной дегидратации достичь не удается вследствие частичного разложения на простые вещества. Растворы оксида палладия в хлорной кислоте содержат плоскоквадратные катионы [Pd(H20)4]2+, однако кристаллические структуры, в которых бы они присутствовали, пока не известны.
В результате взаимодействия гидратированного оксида палладия с щелочами образуются тетрагидроксопалладаты(2), в состав которых входит плоскоквадратный ион [Pd(OH)4]2-. При выпаривании раствора, полученного взаимодействием металла со смесью серной и азотной кислот, выделяются темно-красные кристаллы сульфата PdS04. На воздухе соль расплывается вследствие гидролиза. Из раствора нитрата палладия цианид-ионы осаждают желтую соль Pd(CN)2. Красный роданид Pd(SCN)2 получают действием на K2[PdCl4] роданидом калия. В избытке роданида он растворяется, образуя комплекс K2[Pd(SCN)4]. Коричневый перхлорат Pd(Cl04)2(H20)4 выделяют выпариванием раствора палладия в смеси азотной и хлорной кислот до появления паров хлорной кислоты.
Для платины(2) простые неорганические соли, содержащие акваионы, неизвестны, хотя доказано, что ионы[Pt(H20)4]2+ содержатся в растворах, полученных действием на K2[PtCl4] перхлората серебра. Неустойчивость аквакатиона платины отчасти объясняется легкостью депротонирования координированных молекул воды с образованием гидроксокомплексов, часто представляющих собой димеры.
2).Для лантаноидов в ст.ок.+3 известны многочисленные бинарные соед-ия(Э2О3, ЭНаl3 ,Э2S3, ЭN, ЭН3) и разнообразные соли. В отличие от d-эл-ов к.ч. f-эл-ов могут превышать 9 и достигать 10-14, что объясняют участием f-орбиталей. Высокие к.ч. более характерны для атомов f-эл-ов начала семейства. Дл завершающих семейство эл-ов наиболее типична октаэдрическая структура комплексов. Окраска Э3+ закономерно изм-ся в соответствии с большей или меньшей стабилизацией 4f-сотояния.
Оксиды лантаноидовЭ2О3 высокими энтальпиями и энергиями Гиббса образования. Оксиды-основне соед-ия.В воде практически не раст-ся, но взаим-ют с ней, образуя гидроксиды и выделяя теплоту. Хорошо растворя-ся в хлорово-ой и азото-ой кислотах, но, будучи прокалены, как и Al2O3, теряют хим. активность. С раст-ми щелочей оксиды не взаим-ют. Но для лантаноидов получены кристаллические соед-ия состава LiЭО2, NaЭО2, что свидетельствует об амфотерности Э2О3.
Гидроксиды лантаноидовЭ(ОН)3 получают по обменным реакциям. Соот-но уменьшению радиусов в ряду Се-Lu несколько ослабляется основный характер гидроксидов, и усиливаются признаки амфотерности. В этом же ряду падает их термическая устойчивость и растворимость уменьшается.
Из солей лантаноидовв воде рас-мы хлориды, нитраты, сульфаты, мало растворимы фториды, карбонаты, фосфаты.
Гидриды лантаноидов образуются при взаим-ии простых вещ-в, при нагревании достаточно активно. Все лантаноиды образуют гидриды состава ЭН2, а также соед-ия приближающиеся к составу ЭН3. Гидриды ЭН2 построены по типу флюорита. (АВ2) и имеют солеобразный характер. Они в большей мере напоминают ионные гидриды щелочно-земельных Ме, а с гидридами d-эл-ов имеют мало общего. Водородные соед-ия лантаноидов-химически весьма активные вещ-ва, очень энергично взаим-ют с водой, кислородом, галогенами и др.окислителями. Особо реакционоспособны соед-ия типа ЭН3.
Благодаря высокой Тпл. оксиды, сульфиды, нитриды и карбиды лантаноидов используются для изготовления огнеупорной кермики. Разнообразно применение соед-ий лантаноидов в производстве спец. стёкол.
Особенности поведения церия.Некоторые лантаноиды проявляют степени окисления, отличные от +3. Степень окисления +4 наиболее характерна для тех элементов, которые вместе с потерей четвертого электрона приобретают устойчивую электронную конфигурацию или близкую к ней. Это церий.4f-Орбитали почти не участвуют в образовании химических связей, так как являются внутренними. Следовательно, лантаноиды образуют соединения с преимущественно ионным типом связи (аналогично щелочноземельным элементам). лишь в случае
церия, орбитали оказывают влияние на химические свойства, участвуют в образовании химических связей. Именно
поэтому в химии церия важную роль играют окислительно-восстановительные превращения между соединениями в степенях окисления +3 и +4; это роднит его с d-металлами и сильно отличает от других лантаноидов.
3).Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) осмотическое давление.
1 закон Рауля. Давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя.
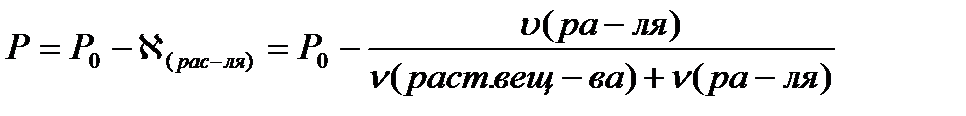
2 закон Рауля. Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества:
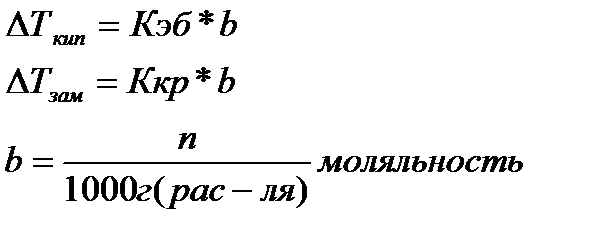 Кэб=0,5; Ккр=1,86
Кэб=0,5; Ккр=1,86
Закон Вант-Гоффа.Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора.
Росм=CRT
Осмос – односторонняя диффузия вещества через полупроницаемую мембрану.
Осмотическое давление – сила, обуславливающая осмос. Оно равно внешнему давлению, при котором осмос видимо прекращается.
Указанные законы справедливы для разбавленных растворов неэлектролитов.
Их можно применять и к растворам электролитов, но в этом случае необходимо вводить изотонический коэффициент Вант-Гоффа (i). Это поправочный коэффициент, который учитывает увеличение числа частиц в растворе электролита из-за диссоциации на ионы.
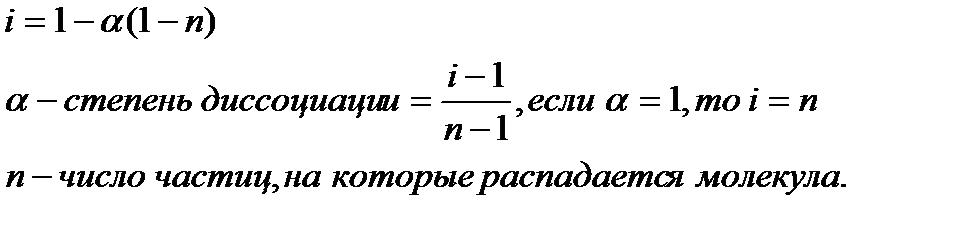
Дата добавления: 2015-08-11; просмотров: 1179;
