Способы расчета изменения энтропии
Из формул Клаузиуса следует, что рассчитать изменение энтропии можно, если известна теплота квазистатического процесса dQqs.
Приведем примеры таких расчетов.
Изохорическое нагревание системы
Теплота, подводимая к системе, рассчитывается по формуле
dQqs=CvdT.
Бесконечно малое изменение энтропии определяется равенством
 . (4 - 7)
. (4 - 7)
Конечное приращение энтропии при нагревании системы от температуры Т1 до температуры Т2 рассчитывается по формуле
 . (4 - 8)
. (4 - 8)
В случае постоянной теплоемкости СV интегрирование по формуле (4 - 8) дает
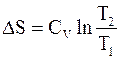 . (4 - 9)
. (4 - 9)
Изобарическое нагревание системы
Теплота, подводимая к системе, рассчитывается по формуле
dQqs= CPdT. (4 - 10)
Бесконечно малое приращение энтропии определяется равенством
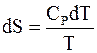 , (4 - 11)
, (4 - 11)
а конечное приращение при нагревании от температуры Т1 до температуры Т2 вычисляется по формуле
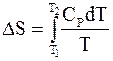 .
.  (4 - 12)
(4 - 12)
Изотермическое расширение идеального газа
Теплота квазистатического расширения идеального газа равна максимальной работе расширения
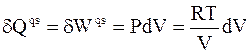 .
.
Бесконечно малое изменение энтропии рассчитаем по формуле
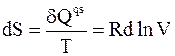 .
.
Конечное приращение энтропии при изотермическом расширении 1 моль газа от объема V1 до объема V2 рассчитывается по формуле
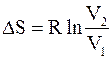 . (4 - 13)
. (4 - 13)
Адиабатические квазистатические процессы
При адиабатических квазистатических процессах энтропия не изменяется (DS=0). По этой причине их называют изоэнтропийными процессами.
Фазовые переходы первого рода
Фазовыми переходами первого роданазывают процессы изменения агрегатного состояния вещества (плавление, испарение, возгонка).
При постоянном давлении процесс фазового перехода протекает при постоянной температуре.
Изменение энтропии при фазовом переходе 1 моля вещества можно рассчитывать по формуле
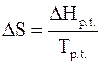 , (4 - 14)
, (4 - 14)
в которой DHp.t. - теплота фазового перехода 1 моль, а Tp.t. - температура фазового перехода.
Дата добавления: 2015-07-24; просмотров: 1640;
