Изменение энтропии при протекании реальных процессов
По теплоте реальных процессов нельзя рассчитать изменение энтропии.
В связи с этим реальный процесс заменяется квазистатическим процессом, условно проводимым от общего для обоих процессов исходного состояния системы до общего для них конечного состояния.
Поясним изложенное примерами.
Истечение идеального газа в пустоту
Пусть в изолированной системе газ занимает первоначальный объем V1. Затем он истекает в вакуум, и его объем увеличивается до V2.
Поскольку газ изолирован от внешней среды, он не может получить теплоту извне. Истечение газа в пустоту не сопровождается работой. Следовательно, внутренняя энергия газа не изменится. В соответствии с законом Гей-Люссака - Джоуля при постоянной внутренней энергии температура также остается постоянной.
Итак, в исходном состоянии с объемом V1 и конечном состоянии с объемом V2 газ имеет одну и ту же температуру. Переход из одного из указанных состояний в другое может быть осуществлен изотермическим расширением газа в квазистатических условиях. В предыдущем параграфе было показано, что в этом случае можно воспользоваться формулой (4 - 13).
Так как конечный объем V2 больше исходного объема V1 и отношение V2/V1 больше 1, то
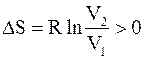 .
.
Полученный результат означает, что изотермическое самопроизвольное расширение газа приводит к возрастанию его энтропии.
Самопроизвольное выравнивание температур
Пример 1.
Рассмотрим систему, состоящую из двух кусков металла, имеющих разные температуры Т1 и Т2. Для простоты расчетов положим, что теплоемкость обоих кусков CV одинакова и не зависит от температуры, а количество вещества в каждом куске равно 1.
При контакте обоих кусков происходит выравнивание температур и устанавливается общая для них температура Те, равная средней арифметической исходных температур:
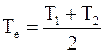 .
.
Изменение энтропии каждого куска металла выразится следующим образом:
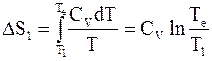 ;
; 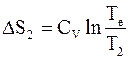 .
.
Общее изменение энтропии находим как сумму изменений для каждого куска металла (используется свойство аддитивности энтропии)
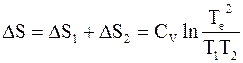 . (4 - 15)
. (4 - 15)
Числитель подлогарифмического выражения, как уже было показано, представляет собой квадрат средней арифметической величины от Т1 и Т2, а знаменатель - квадрат их средней геометрической. Так как средняя арифметическая величина больше средней геометрической, то
DS>0.
Пример 2.
Рассчитаем изменение энтропии при добавлении к 3,6 г воды, взятой при 298 К, 27 г льда, находящегося при 273 К.
Справочные данные: теплоемкость воды Cp равна 75,3 Дж/моль×К (принимается постоянной), изменение энтальпии при плавлении льда равно 6,0 кДж/моль.
Изменение энтальпии (теплота при постоянном давлении) воды при охлаждении от исходной температуры Т1=298 К до температуры плавления льда Т2=273 К рассчитывается по формуле
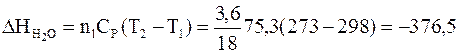 Дж.
Дж.
Рассчитаем количество льда, которое расплавится при поглощении теплоты, выделяемой водой:
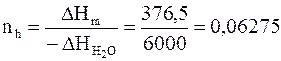 моль.
моль.
Это количество меньше количества льда, имеющегося в системе, т.е. лед расплавится частично.
Изменение энтропии при плавлении льда в соответствии с формулой (4 - 14) составит
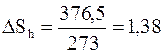 Дж/ К.
Дж/ К.
Изменение энтропии воды рассчитаем по формуле (4 ‑ 12)
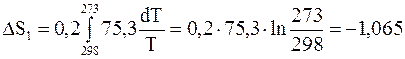 Дж/ К.
Дж/ К.
Общее изменение энтропии находим, используя свойство аддитивности,
DS=DSh +DSl=1,38+(-1,065)=0,315 Дж/ К; DS>0.
Из рассмотренных примеров можно сделать вывод: при самопроизвольном выравнивании температур в системе ее энтропия возрастает.
Дата добавления: 2015-07-24; просмотров: 2407;
