Реальні гази. Рівняння Ван-дер-Ваальса та його аналіз. Зрідження газів
При низькій температурі і високому тискові має спостерігається відхилення газових процесів від законів ідеального газу. Газ стає реальним. Тепер необхідно враховувати: 1) власний об’єм молекул, наприклад, при тискові 100 ат вони займають (1÷2)%; 2) сили взаємодії між молекулами, головним чином сили притягування. Сили відштовхування проявляються на значно менших відстанях, що має місце в твердих тілах. За рахунок цих сил реальний газ уже стиснутий внутрішніми силами.
Враховуючи ці фактори, нідерландський фізик Ван-дер-Ваальс у 1873 р. вивів рівняння стану реального газу. Для 1 моля воно має вид
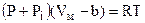 . (6.74)
. (6.74)

 Тут:
Тут: 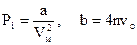 - константи, Рі – внутрішній тиск, Vм – об’єм 1 моля газу, n – концентрація, vo – об’єм однієї молекули. Поправка b враховує власний об’єм молекул, за рахунок чого об’єм, доступний для молекул фактично менший, ніж об’єм посудини. Тому ця поправка віднімається із об’єму. Щоб записати рівняння для довільної кількості газу, необхідно в (6.74) замінити
- константи, Рі – внутрішній тиск, Vм – об’єм 1 моля газу, n – концентрація, vo – об’єм однієї молекули. Поправка b враховує власний об’єм молекул, за рахунок чого об’єм, доступний для молекул фактично менший, ніж об’єм посудини. Тому ця поправка віднімається із об’єму. Щоб записати рівняння для довільної кількості газу, необхідно в (6.74) замінити 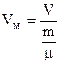 . Після алгебраїчних спрощень одержуємо рівняння Ван-дер-Ваальса для довільної кількості газу
. Після алгебраїчних спрощень одержуємо рівняння Ван-дер-Ваальса для довільної кількості газу 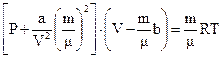 .(6.75)
.(6.75)
Експериментальні ізотерми реального газу зображені на рис.6.35. Рівняння (6.75) добре описує ці криві, за винятком горизонтального участку конденсації (пунктирна лінія). При зменшенні об’єму реального газу його тиск зростає. В певному стані (точки с) починається конденсація. Виникає рідина і тиск дорівнює тискові насиченої пари. При незмінній температурі він залишається сталим, поки вся пара не перейде в рідку фазу (точки d). З ростом температури ділянка cd конденсації скорочується і при критичній температурі ТК вироджується в точку. Стан, який їй відповідає, називається критичним, коли в рівновазі знаходяться всі три фази: тверда, рідка і газоподібна. Параметри цього стану TК, PК, VК для різних речовин різні. Наприклад, для води: VК = 56 м3/моль, PК = 218 ат, TК = 374оС. При Т > TК рідка фаза не існує при будь-якому тиску. Отже, для зрідження газу шляхом його стискання необхідно знизити температуру нижче за критичну.

 Лінія, яка з’єднує точки c початку і точки d кінця конденсації (рис.6.36) разом з ізотермою при критичній температурі ТК поділяє Р-V – діаграму на чотири області: 1) газ; 2) ненасичена пара; 3) насичена пара + рідина; 4) рідина.
Лінія, яка з’єднує точки c початку і точки d кінця конденсації (рис.6.36) разом з ізотермою при критичній температурі ТК поділяє Р-V – діаграму на чотири області: 1) газ; 2) ненасичена пара; 3) насичена пара + рідина; 4) рідина.
Дата добавления: 2015-06-17; просмотров: 1286;
