Газовые законы. Уравнение Менделеева-Клапейрона.
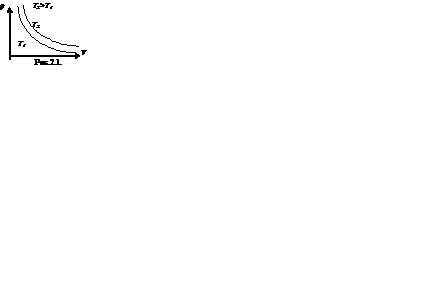
Экспериментальное исследование свойств газов, проведенное в ХVII-XVIII вв. Бойлем, Мариоттом, Гей-Люссаком, Шарлем, привело к формулировке газовых законов.
1. Изотермический процесс – Т=const.
Закон Бойля-Мариотта: pV=const.
 График зависимости p от V приведен на рис.2.1. Чем выше изотерма, тем более высокой температуре она соответствует, T2>T1.
График зависимости p от V приведен на рис.2.1. Чем выше изотерма, тем более высокой температуре она соответствует, T2>T1.
2. Изобарный процесс– p = const.
Закон Гей-Люссака: 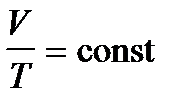 .
.
График зависимости V от T приведен на рис. 2.2. Чем ниже к оси температуры наклонена изобара, тем большему давлению она соответствует, р2 > p1.
3. Изохорный процесс– V=const.
 Закон Шарля:
Закон Шарля: 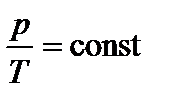 .
.
График зависимости р от Т изображен на рис 2.3. Чем ниже к оси температуры наклонена изохора, тем большему объему она соответствует, V2 > V1.
Комбинируя выражения газовых законов, получим уравнение, связывающее р, V, Т (объединенный газовый закон): 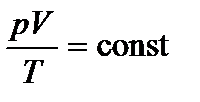 .
.
Постоянная в этом уравнении определяется экспериментально. Для количества вещества газа 1 моль она оказалась равной R=8,31 Дж/(моль×К) и была названа универсальной газовой постоянной.
1 моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. Число молекул (структурных единиц) в 1 моле равно числу Авогадро: NA=6,02.1023моль-1. Для R справедливо соотношение: R=k NA
Итак, для одного моля: 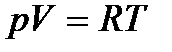 .
.
Для произвольного количества газа n = m/m, где m - молярная масса газа. В результате получим уравнение состояния идеального газа, или уравнение Менделеева-Клапейрона 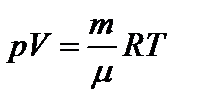 .
.
Дата добавления: 2015-04-01; просмотров: 3055;
