Внутренняя энергия термодинамической системы. Работа и теплота в термодинамике. Теплоемкость газов.
Термодинамика изучает количественные закономерности превращения энергии, обусловленные тепловым движением молекул.
Одним из основных понятий термодинамики являетсявнутренняя энергия.Под внутренней энергией U в термодинамике понимают сумму кинетической энергии теплового движения частиц, образующих систему, и потенциальную энергию их взаимного положения.
Для идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа представляет собой полную кинетическую энергию его хаотически движущихся молекул. Она равна: 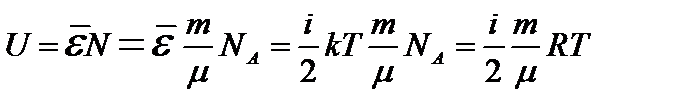 . (1)
. (1)
Из формулы (1) видим, что изменение внутренней энергии данной массы газа прямо пропорционально его абсолютной температуре и не зависит от других макроскопических параметров: 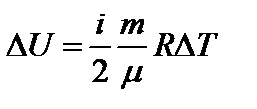 .
.
Это означает, что изменение внутренней энергии при переходе из одного состояния в другое не зависит от пути перехода. Величина, изменение которой не зависит от пути перехода в термодинамике называется функцией состояния: DU=U2-U1 не зависит от вида процесса. Внутренняя энергия является функцией состояния.
Еще одним важным понятием в термодинамике является работа. Рассмотрим процесс расширения газа. Пусть в цилиндрическом сосуде заключен газ, закрытый подвижным поршнем (рис.5.1). Предположим, что газ расширяется. Он будет перемещать поршень и совершать над ним работу. При малом смещении dx газ совершит работу:
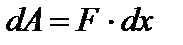 , где F – сила, с которой газ действует на поршень, р – давление газа в начале пути dx. Следовательно,
, где F – сила, с которой газ действует на поршень, р – давление газа в начале пути dx. Следовательно, 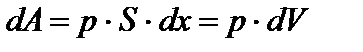 ,
,
где dV — малое изменение объема газа. Работа, совершаемая при конечных изменениях объема, должна вычисляться путем интегрирования. Полная работа расширения: 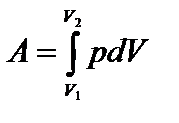 .
.
На графике (р,V) работа равна площади фигуры, ограниченной двумя ординатами и функцией p(V). Предположим, система переходит из одного состояния в другое, совершая работу по расширению, но двумя различными путями I и II (рис.5.2). AI численно равна площади фигуры, ограниченной кривой I, АII – площади фигуры, ограниченной кривой II: AI№ АII. Работа различна, следовательно, работа не является функцией состояния. Работу считают положительной, если ее совершает система, и отрицательной, если она совершается над системой.
Процесс передачи энергии от одного тела к другому без совершения работы называется теплообменом или теплопередачей. Энергия, переданная телу в результате теплообмена, называется количеством теплоты  .
.
Величину  считают положительной, если система получает теплоту, и отрицательной, если она ее отдает. В СИ единицей количества теплоты служит джоуль.
считают положительной, если система получает теплоту, и отрицательной, если она ее отдает. В СИ единицей количества теплоты служит джоуль.
Удельной теплоемкостью вещества с называется скалярная величина, равная количеству теплоты, необходимого для нагревания единицы массы тела на один кельвин (т.е.отношению теплоемкости однородного тела С к его массе): 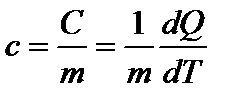 . [c]= Дж/(кг.К)
. [c]= Дж/(кг.К)
Молярной теплоемкостью называется физическая величина, численно равная количеству теплоты, необходимого для нагревания одного моля вещества тела на один кельвин (т.е. отношению теплоемкости системы С к количеству вещества n, содержащегося в ней): 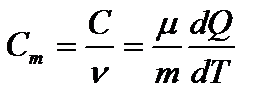 . [Cm]=Дж/(моль.К)
. [Cm]=Дж/(моль.К)
Дата добавления: 2015-04-01; просмотров: 2077;
