Первое начало термодинамики и его применение для различных процессов.
Первое начало термодинамики выражает закон сохранения энергии для тех макроскопических явлений, в которых одним из существенных параметров, определяющих состояние тел, является температура.
Теплота, сообщенная системе в процессе изменения ее состояния, расходуется на изменение ее внутренней энергии и на совершение работы против внешних сил. 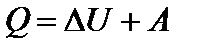 (1)
(1)
Часто приходится разбивать рассматриваемый процесс на ряд элементарных процессов, каждый из которых соответствует весьма малому изменению параметров системы. Запишем уравнение (1) для элементарного процесса в дифференциальном виде: dQ=dU+dA, (2)
где dU – малое изменение внутренней энергии; dQ – элементарное количество теплоты; dА – элементарная работа. Возможны и другие варианты формулировки этого закона. 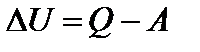 (3)
(3)
Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме совершенной над системой работы внешних сил и теплоты, переданной системе внешними телами.
Из уравнений (1)-(3) видно, что если процесс круговой, т.е. в результате него система возвращается в исходное состояние, то DU = 0 и, следовательно, А=Q. В круговом процессе все тепло, полученное системой, идет на производство внешней работы. Если Q =0, то и А = О. Это значит, что невозможен процесс, единственным результатом которого является, производство работы без каких бы то ни было изменений в других телах, т.е. невозможен – вечный двигатель – первого рода.
Для равновесных изопроцессов в газах уравнение первого начала термодинамики (dQ = dU + dА) имеет вид: 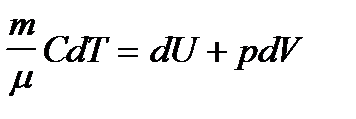 .
.
1) V=const, dV=0, dA=pdV=0 Þ 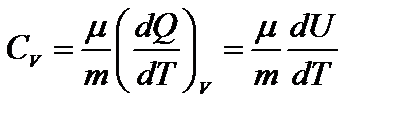 ; где CV – молярная теплоемкость при постоянном объеме.
; где CV – молярная теплоемкость при постоянном объеме.
Первое начало термодинамики при изохорном процессе: 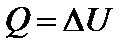 или
или 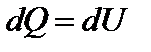
Тепло, передаваемое системе при изохорном процессе, идет на изменение ее внутренней энергии.
Здесь 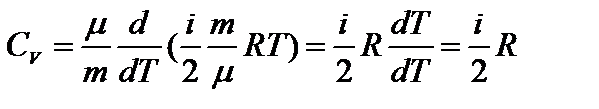 ;
; 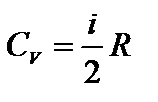 ;
;
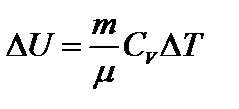 или
или 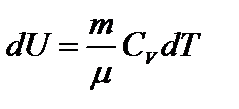
2) р=const:
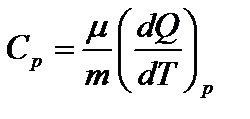 – молярная теплоемкость при постоянном давлении. График изобарического процесса представлен на (рис.6.1). Работа изобарного расширения равна площади фигуры, заштрихованной на рис. и имеет значение
– молярная теплоемкость при постоянном давлении. График изобарического процесса представлен на (рис.6.1). Работа изобарного расширения равна площади фигуры, заштрихованной на рис. и имеет значение 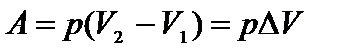 .
.
Первое начало термодинамики при изобарном процессе: 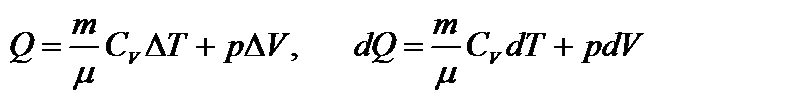
Здесь же мы сможем установить связь между Ср и. СV и сформулировать физический смысл универсальной газовой постоянной. Первый закон термодинамики для р=const: 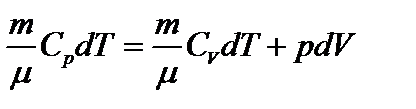 .
.
Из уравнения Менделеева-Клапейрона: 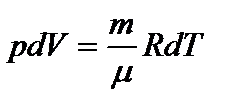 . Тогда:
. Тогда:
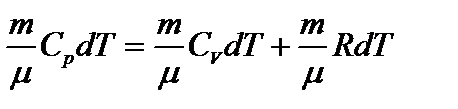 , или
, или 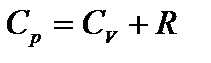 – уравнение Майера.
– уравнение Майера.
Отсюда физический смысл R: универсальная газовая постоянная численноравна работе, которую необходимо совершить, чтобы нагреть 1 моль вещества на 1 К при постоянном давлении.
3) Т=const: dT=0;
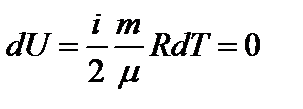 Þ
Þ 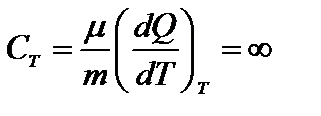
Первое начало термодинамики при Т=const:
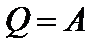 или
или 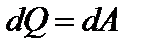
Теплота, сообщаемая системе при изотермическом процессе, идет на работу против внешних сил. Если газ изотермически расширяется (V2>V1), то к нему подводится тепло и он совершает положительную работу, которая измеряется площадью, заштрихованной на рисунке фигуры.
4) Адиабатным называется процесс, протекающий без теплообмена с внешней средой: dQ=0, Q=0. Чтобы процесс был адиабатным, необходимо, чтобы система была отделена от окружающих тел теплонепроницаемой перегородкой, либо процесс должен быть очень быстро протекающим, чтобы не успел установиться теплообмен. Первый закон термодинамики для адиабатного процесса:
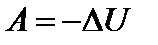 или
или 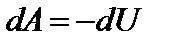
Работа при адиабатическом процессе совершается за счет убыли внутренней энергии. Одно из уравнений, с помощью которых можно описать адиабатный процесс: 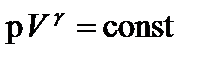 , где
, где
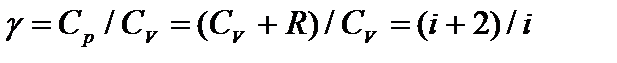 .
.
Величина g называется показателем адиабаты. Она всегда больше единицы g>1. При сопоставлении адиабатного и изотермического процессов видно, что адиабата проходит более круто.
Дата добавления: 2015-04-01; просмотров: 2058;
