Кинетической теории газов.Закон Дальтона.
Примером простейшей системы, изучаемой в молекулярной физике, является газ. Газы рассматриваются как системы, состоящие из очень большого числа частиц (до 1026м–3), находящихся в постоянном беспорядочном движении. Состояние газа характеризуется совокупностью трех параметров р, V, Т , которые называются параметрами состояния. Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В настоящее время можно применять только две температурные шкалы, градуированные соответственно в кельвинах (К) и в градусах Цельсия (°С). Давление в системе СИ измеряется в Па (паскаль): 1Н/м2=1 Па.
В молекулярно-кинетической теории пользуются модельюидеального газа, согласно которой считают, что: 1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда; 2) между молекулами газа отсутствуют силы взаимодействия; 3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как в условиях, близких к нормальным, а также при низких давлениях и высоких температурах большинство газов близко по своим свойствам к идеальному газу.
Основным уравнением кинетической теории газов называется соотношение, связывающее давление (величину, измеряемую на опыте) со скоростью или кинетической энергией молекулы газа.
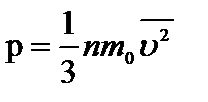 (1)
(1)
Это уравнение как раз и устанавливает связь между давлением и среднеквадратичной скоростью. Здесь 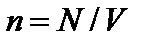 – число молекул в единице объема или концентрация,
– число молекул в единице объема или концентрация, 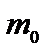 –масса одной молекулы газа;
–масса одной молекулы газа; 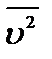 – квадрат средней квадратичной скорости молекул (
– квадрат средней квадратичной скорости молекул ( 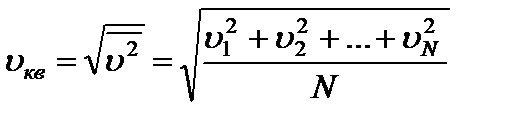 ).
).
Давление газа пропорционально произведению массы молекулы, концентрации молекул и среднему квадрату скорости движения молекул.
Средняя кинетическая энергия хаотического поступательного движения одной молекулы: 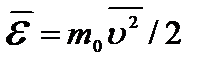 . Тогда основное уравнение запишется в виде:
. Тогда основное уравнение запишется в виде: 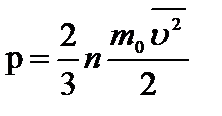 или
или 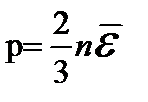 (2)
(2)
В уравнении (2) давление связано со средней энергией поступательного движения молекул. Давление газа численно равно 2/3 средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
При переходе к равновесию от одной части газа к другой передается энергия. Выравнивается не энергия всего газа как целого, а средняя кинетическая энергия, отнесенная к одной молекуле. Температура газа пропорциональна средней кинетической энергии его молекул: Т ~ `E. Средняя кинетическая энергия поступательного движения молекулы `E = 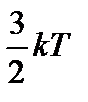 , (3)
, (3)
где k – постоянная Больцмана, выражающая соотношение между единицей энергии и единицей температуры. k=1,38.10-23 Дж/К. Все молекулы при данной температуре Т имеют одну и ту же среднюю энергию независимо от их сорта. Из формулы (1) следует, что абсолютная температура является мерой средней кинетической энергии поступательного хаотического движения молекул.
Выразим среднюю квадратичную скорость uкв через абсолютную температуру Т. Приравнивая правые части в формулах `E = 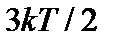 и `E
и `E 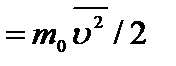 , получим:
, получим: 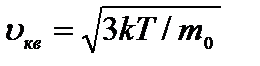 .
.
Подставляя в основное уравнение кинетической теории газов выражение для средней квадратичной скорости, получим, что давление идеального газа связано с температурой соотношением: 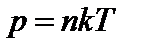
Это третья форма записи основного уравнения кинетической теории газов. Давление определяется только концентрацией (при постоянной температуре) и не зависит от сорта молекул.
Если имеем смесь нескольких идеальных газов, то согласно закону Дальтона 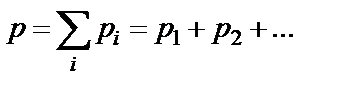 .
.
Давления 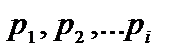 называют парциальными давлениями. Парциальное давление – давлению, которое оказывала бы компонента смеси газа, если бы она занимала весь объем. Таким образом, давление, оказываемое на стенки сосуда смесью газов, равно сумме парциальных давлений отдельных компонентов смеси.
называют парциальными давлениями. Парциальное давление – давлению, которое оказывала бы компонента смеси газа, если бы она занимала весь объем. Таким образом, давление, оказываемое на стенки сосуда смесью газов, равно сумме парциальных давлений отдельных компонентов смеси.
Дата добавления: 2015-04-01; просмотров: 2073;
