Введение. Законы идеального газа. Уравнение Менделеева-Клайперона
Молекулярная физика – раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Процессы, изучаемые молекулярной физикой, являются результатом совместного действия большого числа молекул. Законы поведения огромного числа молекул изучаются с помощью статистического метода. Этот метод основан на том, что свойства макроскопической системы определяются свойствами частиц системы, особенностями их движения и усредненнымизначениями динамических характеристик этих частиц (скорости, энергии и т. д.).
Температура – одно из основных понятий, играющих важную роль не только в термодинамике, но и в физике в целом. Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В настоящее время применяют две температурные шкалы –термодинамическую и Международную практическую,градуированные соответственно в кельвинах (К) и в градусах Цельсия (°С).
Между температурами в шкале Кельвина и Цельсия имеется следующая связь
Т=273+t
Температура T=0 К называется нулем по шлале Кельвина.
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа,согласно которой считают, что:
1) собственный объем молекул газа мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда считают абсолютно упругими.
На основании многочисленных экспериментов были установлены следующиегазовые законы.
Закон Бойля - Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная: pV = const
при Τ = const, m = const (6.1)
Кривая, изображающая зависимость между величинами р и V,характеризующими свойства вещества при постоянной температуре, называется изотермой.Изотермы представляют собой гиперболы, расположенные на графике (рис.6.1) тем выше, чем выше температура, при которой происходит процесс.
Закон Гей – Люссака.
Объем данной массы газа при постоянном давлении изменяется линейно с температурой:
 V = V0(1+αt), при p = const, и m = const; (6.2)
V = V0(1+αt), при p = const, и m = const; (6.2)
Рис.6.1 Рис.6.2 Рис.6.3
Закон Шарля.
Давление данной массы газа при постоянном объеме изменяется линейно с температурой:
p = p0(1+ at) при V = const, т = const (6.3)
В этих уравнениях t – температура по шкале Цельсия, p0и V0— давление и объем при 0°С, коэффициент a= 1/273,15 К-1.
Процесс, протекающий при постоянном давлении, называется изобарным.На диаграмме в координатах V, t (рис.6.2) этот процесс изображается прямой, называемой изобарой. Процесс, протекающий при постоянном объеме, называется изохорным. На диаграмме (рис.6.3) в координатах р, t он изображается прямой, называемой изохорой.
Из (6.2) и (6.3) следует, что изобары и изохоры пересекают ось температур в точке t= -1/a= -273,15 °С, определяемой из условия 1+at= 0. Если перенести начало отсчета в эту точку, то происходит переход к шкале Кельвина, откуда Τ = t+1/a.
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы.Принормальных условиях этот объем равен 22,41×10-3 м3/моль.
По определению, в одном моле различныхвеществ содержится одно и то же число молекул, называемое постоянной Авогадро:
NА = 6,022 .1023 моль-1.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений р1, р2,···, рп, входящих в нее газов:
p = р1 + р2 + ... + рп.
Парциальноедавление – давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р,объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде дается выражением: F(p, V, T)=0, где каждая из переменных является функцией двух других.
Французский физик Б. Клапейрон вывел уравнение состояния идеального газа, объединив законы Бойля-Мариотта, Гей-Люссака и Шарля.
pV/T = const. (6.4)
Выражение (6.4) является уравнением Клапейрона.
Д. И. Менделеев объединил уравнение Клапейрона с законом Авогадро и получил уравнение, которое называется уравнением Клапейрона – Менделеева
pV = 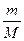 RT = vRT,(6.5)
RT = vRT,(6.5)
где: v=m/M – количество вещества, т – масса газа, Μ – молярная масса, R=8,31 Дж/(моль К) – универсальная газовая постоянная.
Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана
k=R/NA= 1,38∙10-23 Дж/К.
Исходя из этого, уравнение состояния (6.5) запишем в виде
p= RT/Vm = kNAT/Vm = nkT,
где NA/Vm=n – концентрация молекул (число молекул в единице объема). Таким образом, из уравнения
p=nkT (6.6)
следует, что давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. Число молекул, содержащихся в 1м3 газа при нормальных условиях, называется числом Лошмидта:
Nl = р0/(kТ0)= 2,68∙1025 м-3.
Дата добавления: 2015-06-17; просмотров: 2310;
