Визначення вмісту НСl і Н3РО4 при їх сумісній присутності методом потенціометричного титрування
Потенціометричне визначення вмісту НСl і Н3РО4 при їх сумісній присутності основане на різній силі цих кислот (НСl є сильною, а Н3РО4 ― набагато слабшою кислотою).
Константи іонізації ортофосфатної кислоти мають такі значення:
Н3РО4 D Н+ + Н2РО4– К1 = 7,6·10–3; рК1 = 2,12
Н2РО4– D Н+ + НРО42– К2 = 6,2·10–8; рК2 = 7,21
НРО42– D Н+ + РО43– К3 = 4,2·10–13; рК3 = 12,36.
При потенціометричному титруванні суміші одноосновних кислот різної сили сильною основою можна визначити вміст кожної кислоти без їх розділення, якщо відношення констант їх іонізації буде не менше, ніж 104, а константа іонізації слабшої кислоти ≥ 10–8.
При титруванні багатоосновних кислот на кривих титрування з’являється кілька точок перегину, що пояснюється ступінчатою іонізацією кислоти, продукти іонізації якої ведуть себе подібно до суміші кислот різної сили.
Тому на кривій потенціометричного титрування Н3РО4 розчином NaOH спостерігаються два стрибки, які відповідають нейтралізації Н3РО4 за І та ІІ ступенями. За ІІІ ступенем Н3РО4 не титрується, бо К3 < 10–8.
При потенціометричному визначенні вмісту НСl і Н3РО4 титруванням їх суміші розчином NаОН, будуть спостерігатися дві т.е., які на графіку зобразяться двома стрибками рН.
Перший стрибок рН відповідає відтитруванню НСl і Н3РО4 за І ступенем:
НСl + NаОН = NаСl + Н2О,
Н3РО4 + NаОН = NaH2PO4 + H2O.
В першій т.е. в розчині знаходяться NаСl і NaH2PO4, тому величину рН1, яка визначається присутністю NaH2PO4, розраховують за формулою:
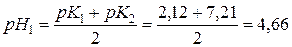 .
.
Оскільки відношення констант іонізації НСl і Н3РО4 за І ступенем є меншим, ніж 104: 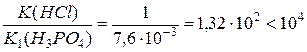 , то хлоридна і фосфатна кислота за І ступенем відтитровуються разом.
, то хлоридна і фосфатна кислота за І ступенем відтитровуються разом.
Другий стрибок рН відповідає відтитруванню Н3РО4 за ІІ ступенем:
NaH2PO4 + NаОН = Na2HPO4 + H2O.
В другій т.е. в розчині знаходиться Na2НРO4 і рН розраховують за формулою:
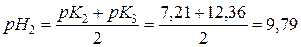 .
.
Оскільки відношення констант іонізації H3PO4 за І та ІІ ступенем є більшим, ніж 104: 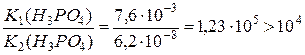 , тому H3PO4 титрується окремо за цими ступенями. Титрування H3PO4 за ІІІ ступенем зафіксувати не можна, бо К3(H3PO4) = 4,2·10–13 < 10–8.
, тому H3PO4 титрується окремо за цими ступенями. Титрування H3PO4 за ІІІ ступенем зафіксувати не можна, бо К3(H3PO4) = 4,2·10–13 < 10–8.
В результаті потенціометричного титрування суміші двох кислот різної сили одержують два стрибки рН на кривих титрування (Рис. 4).
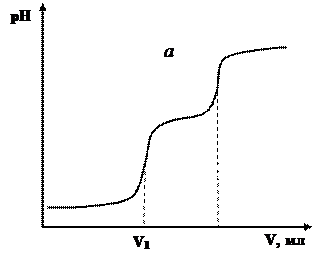
|
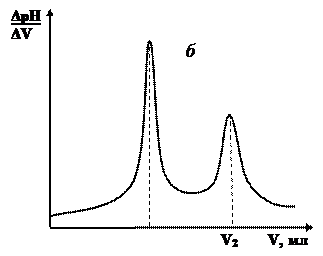
| ||||
| Рис. 4. Інтегральна (а) та диференційна (б) криві потенціометричного титрування суміші кислот різної сили. |
Дата добавления: 2015-02-28; просмотров: 2273;
