ПОТЕНЦІОМЕТРИЧНИЙ МЕТОД АНАЛІЗУ
Метод визначення кількості речовини, оснований на вимірюванні потенціалу електроду, зануреного в досліджуваний розчин, називається потенціометричним.
Значення електрохімічного потенціалу залежить від природи речовин, концентрації (активності) їх іонів у розчині та температури. Ця залежність описується рівнянням Нернста:
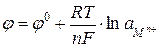 або
або 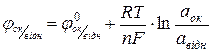 , (1.1)
, (1.1)
де φ – потенціал індикаторного електрода при даній активності речовини; φ0 – стандартний потенціал; аМn+, аок, авідн - активності іонів металу, окисненої та відновленої форм речовини, відповідно; R – універсальна газова стала; Т – абсолютна температура; n – число електронів, які беруть участь у даній електрохімічній реакції.
Якщо R = 8,314 Дж/моль·К, Т = 298 К, F = 96485 Кл/моль і при переході до десяткового логарифму рівняння (1.1) записують у вигляді:
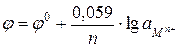 або
або 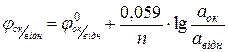 , (1.2)
, (1.2)
Ці залежності є основою потенціометричних методів аналізу ― прямої потенціометрії та потенціометричного титрування.
Аналітичним сигналом методу є значення величини потенціалу.
Оскільки значення потенціалу залежить не тільки від природи речовини, а й від її концентрації, тому потенціометричні методи не можуть бути використані для якісного аналізу.
В основі кількісного аналізу лежить лінійна залежність потенціалу електрода від логарифма концентрації (активності) аналізованої речовини, або логарифма відношення концентрацій (активностей) окисненої і відновленої форми цієї речовини.
Метод прямої потенціометрії оснований на вимірюванні точного значення електродного потенціалу і обчисленні концентрації визначуваних іонів. Пряма потенціометрія широко використовується для визначення концентрації водневих іонів в розчині за допомогою скляного індикаторного електрода та хлоридно-срібного електрода порівняння. Електрорушійна сила (ЕРС) такої комірки описується формулою:
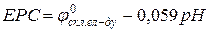 . (1.3)
. (1.3)
Метод потенціометричного титрування ― це титриметричний метод аналізу, в якому точку еквівалентності визначають за зміною потенціалу індикаторного електрода в процесі титрування визначуваної речовини стандартним розчином відповідного реаґенту. Точка еквівалентності характеризується різкою зміною (стрибком) потенціалу.
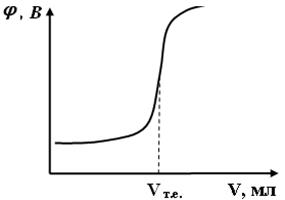
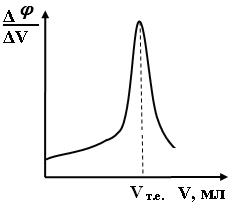
Характерна крива потенціометричного титрування показана на рис. 1, де по осі ординат відкладені значення потенціалу (φ, В) або рН розчину, а по осі абсцис ― об’єм титранту (V, мл). Графічно можна встановити точку еквівалентності (т.е.) як точку перетину перпендикуляра, опущеного з середини перегину кривої, з віссю абсцис. Якщо по осі ординат відкласти відношення Δφ/ΔV або ΔpH/ΔV, то одержимо диференційну криву (рис. 2), яка дає можливість точніше визначити т.е. за максимумом на кривій титрування.
| 
|
| Рис. 1. Крива потенціометричного титрування | Рис. 2. Диференційна крива потенціометричного титрування |
Потенціометричне титрування можна використати для аналізу мутних і забарвлених розчинів, слабких і дуже слабких кислот та основ, суміші кислот та основ різної сили, солей, багатоосновних кислот.
Переваги методу: висока точність, добра відтворюваність результатів, різка зміна потенціалу індикаторного електрода біля точки еквівалентності, відсутність індикаторної похибки, можливість титрування розбавлених розчинів та визначення кількох компонентів в суміші без розділення.
При потенціометричних вимірюваннях у досліджуваний розчин опускають два електроди ― індикаторний і порівняння, які з’єднують з приладом ― потенціометром, іономіром або рН-метром.
Індикаторні електроди ― це електроди, значення потенціалу яких залежить від концентрації (активності) визначуваної речовини, або від відношення концентрацій (активностей) окисненої і відновленої форм цієї речовини. Індикаторні електроди вибирають залежно від типу реакції та природи визначуваної речовини.
У окисно-відновних реакціях використовують індиферентні платиновий або золотий електроди, які чутливі до зміни концентрації окисненої та відновленої форми досліджуваної речовини.
У реакціях нейтралізації використовують скляний, водневий або хінгідронний електроди, які чутливі до зміни концентрації іонів водню.
Іоноселективні електроди мають високу специфічність до окремих іонів (Cl–, Br–, I–, F–, NO3–, S2–, CN–, SCN–, PO43–, CO32–, NH4+, K+, Na+, Li+, Ca2+, Sr2+, Ba2+, Cu2+, Fe2+, Fe3+) і використовуються для їх визначення.
В реакціях осадження та комплексоутворення найчастіше використовують металеві електроди із срібла і ртуті, які призначені для визначення концентрації Ag+, Hg2+, Cl–, Br–, I–, CN–.
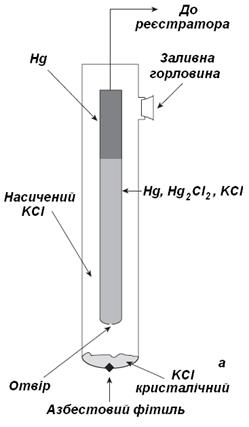
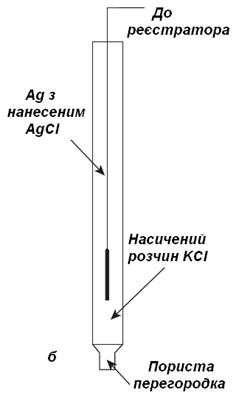
Електроди порівняння (стандартні електроди) ― це електроди, які мають відоме і постійне значення потенціалу при постійній температурі. Всі ці електроди є електродами другого роду, які містять метал в контакті з його малорозчинною сіллю, занурений в розчин електроліту з аніоном малорозчинної солі більшої концентрації. Найчастіше використовують насичений каломельний Hg, Hg2Cl2 | KCl || (рис. 3а) та хлоридно-срібний Ag, AgCl | KCl || (рис. 3б) електроди, які мають високу відтворюваність і є компактними.
|
|
| Рис. 3. Електроди порівняння: а - насичений каломельний; б - хлоридно-срібний |
Експериментально можна виміряти лише різницю електрохімічних потенціалів, а не абсолютне значення потенціалу. Індикаторний електрод і електрод порівняння, сполучені послідовно, складають гальванічний ланцюг, ЕРС якого дорівнює:
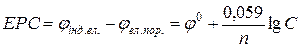 . (1.4)
. (1.4)
За виміряним значенням ЕРС розраховують концентрацію іону.
Дата добавления: 2015-02-28; просмотров: 12781;
