КУЛОНОМЕТРИЧНИЙ МЕТОД АНАЛІЗУ
Кулонометрія грунтуються на вимірюванні кількості електрики, яка витрачається на електрохімічну реакцію. В основі кулонометрії лежать закони електролізу ― закони Фарадея.
1. Маса речовини, що вступила в електродну реакцію або виділилася в результаті її проходження, пропорційна кількості затраченої електрики.
2. Однакові кількості електрики виділяють з різних хімічних сполук маси речовини, які пропорційні молярним масам їх електрохімічних еквівалентів.
Математично закони Фарадея описуються формулами
 , (2.1)
, (2.1)
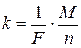 , (2.2)
, (2.2)
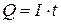 , (2.3)
, (2.3)
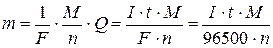 , (2.4)
, (2.4)
де m ― маса визначуваної речовини, г; М ― молярна маса речовини, г/моль; n ― число електронів; I ― сила струму, А; t ― тривалість електролізу, с; F ― постійна Фарадея, 96500 Кл/моль-екв.
Аналітичним сигналом кулонометричних методів аналізу є кількість електрики, яка витрачається на електроліз аналізованої або допоміжної речовини. Необхідною умовою кулонометричних визначень є відсутність побічних електрохімічних реакцій (100 %-й вихід за струмом):
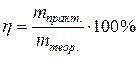
Залежно від того, які електрохімічні процеси відбуваються в розчині, розрізняють пряму кулонометрію і непряму (кулонометричне титрування).
Кулонометричний аналіз можна проводити при заданому постійному потенціалі (потенціометрична кулонометрія) або при постійній силі струму (амперометрична кулонометрія).
Пряму (потенціометричну) кулонометрію можна використовувати для визначення тільки електродноактивних речовин, тобто здатних окиснюватись на аноді або відновлюватись на катоді.
Широко використовується непряма (амперометрична) кулонометрія, яку називають кулонометрією з електроґенеруванням реаґента, або кулонометричним титруванням. Електроліз здійснюється при постійній силі струму (І ≈ 10–5 А) з використанням допоміжної речовини, з якої на катоді чи аноді ґенерується (утворюється) реаґент, що зразу ж хімічно взаємодіє з аналізованою речовиною. Методом кулонометричного титрування можна визначати малі кількості як електродноактивних, так і неелектродноактивних речовин, наприклад; Сu2+, O2, Al3+, U4+, U6+, Ce4+, Cr2O72–, MnO4–, С2О42–, S2O32–, І–, Br–, Сl–, Br2, І2, мінеральні та органічні кислоти і основи з рК ≥ 7 та ряд інших речовин.
Кінець електрохімічної реакції (електролізу) встановлюють потенціо-метрично, амперометрично або індикаторним методом. Чутливість методу визначається чутливістю способу індикації кінця титрування (до ~ 10–9 г), точністю вимірювання часу та сили струму. Похибка визначення складає 0,1–0,01 %.
Кулонометричний аналіз має ряд суттєвих переваг порівняно з іншими фізико-хімічними методами: надійність визначення як малих, так і великих кількостей речовини з високою точністю і відтворюваністю, легкість автоматизації, можливість використання нестійких реаґентів, виключення стандартних розчинів, швидкість визначення.
Дата добавления: 2015-02-28; просмотров: 3350;
