Кондуктометричні методи аналізу
Кондуктометричні методи аналізу грунтуються на залежності електричної провідності розчинів електролітів від їх складу.
Електричною провідністю називають здатність речовин проводити електричний струм під дією зовнішнього джерела електричного поля. Для її вимірювання в розчин занурюють два індиферентних електроди, до яких прикладають напругу від джерела струму. Щоб запобігти зміні складу розчину завдяки електролізу і зменшити поляризацію електродів при вимірюванні електропровідності розчинів електролітів, використовують змінний струм. Електричну провідність розраховують за формулою:
 , (3.1)
, (3.1)
де W – електрична провідність, См; І - сила струму, А; U - напруга, В.
Електрична провідність прямо пропорційна площі електродів (S) і обернено пропорційна відстані між ними (l):
 , (3.2)
, (3.2)
де æ - питома електрична провідність, що дорівнює електричній провідності розчину, розташованого між плоскими електродами площею 1 см2 на відстані 1 см один від одного:
 (3.3)
(3.3)
Відношення l/S називають константою електролітичної комірки.
Питома електрична провідність, віднесена до числа моль-еквівалентів йонів в 1 см3 розчину, називається еквівалентною електричною провідністю, або рухливістю (l):
 , (3.4)
, (3.4)
де С - концентрація йонів, моль-екв/дм3.
Питома та еквівалентна електропровідності залежать від властивостей йонів і їх концентрації, температури та природи розчинника.
При зменшенні концентрації електролітів еквівалентна електрична провідність наближається до певного постійного значення λ0, яке називається граничною еквівалентною провідністю при безмежному розбавленні, або граничною рухливістю.
Гранична рухливість розчину електроліту є адитивною величиною і складається з граничних рухливостей всіх катіонів λ+ та аніонів λ-, що входять до його складу:
l0 = l+ + l– (закон Кольрауша) (3.5)
Гранична еквівалентна електропровідність є фізико-хімічною константою йонів у певному розчиннику при певній температурі.
Аналітичний сигнал кондуктометрії (W або æ) є одномірним і неселективним, його величина залежить від природи і концентрації всіх йонів, які знаходяться в розчині:
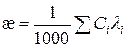 (3.6)
(3.6)
Тому якісний аналіз цим методом проводити не можна.
Відомо декілька методів кондуктометричного аналізу: пряма кондуктометрія, кондуктометричне та хронокондуктометричне титрування.
Пряма кондуктометрія використовується для аналізу бінарних, псевдобінарних розчинів і контролю чистоти розчинників. Визначення концентрації електролітів проводять методом абсолютного калібрування або заздалегідь визначають, яка питома електрична провідність відповідає необхідній чистоті розчинника. Очистку проводять доти, доки провідність очищеного зразка стане меншою, ніж визначене значення.
Переваги методу прямої кондуктометрії: простота, надійність, достатня точність результатів (1-2%), доступне обладнання. Недоліки: обмеженість об’єктів аналізу, вплив забруднення сторонніми електролітами на результати.
Найширше застосування одержав метод кондуктометричного титрування, який полягає в побудові залежності електричної провідності розчину від об’єму титранта і визначенні точки еквівалентності за зламом на кривій титрування. Злам на кривій спостерігається, якщо одним із продуктів реакції є малодисоційована сполука або відбувається перетворення йонів у молекулярну форму і навпаки.
Аналізований розчин наливають в електрометричну комірку з перемішуючим пристроєм (магнітною мішалкою). Розчин титранта однаковими порціями додають у комірку і через деякий час записують електричну провідність розчину. Якщо титрування триває декілька хвилин, комірку можна не термостатувати. Для одержання точніших результатів і при тривалому титруванні електрометричну комірку термостатують.
При кондуктометричному титруванні використовують реакції нейтралізації, осадження, комплексоутворення та окиснення-відновлення. Залежно від природи речовин, які беруть участь у процесі титрування, можливі різні форми кривих титрування. Основні з них наведені на рисунку 8.

Рис. 8. Основні форми кривих кондуктометричного титрування.
Точність кондуктометричного титрування залежить від характеру зламу кривої титрування в точці еквівалентності. Її можна фіксувати і за часом, який минув від початку титрування до зламу на кривій. Такий варіант аналізу називають хронокондуктометричним титруванням.
Перевагою кондуктометричного титрування є можливість проведення аналізу каламутних і забарвлених розчинів, використання різних титриметричних методів, визначення органічних і неорганічних сполук, диференційованного титрування сумішей декількох компонентів без розділення. Нижня межа визначуваних концентрацій - 10-4 моль/дм3 при точності не менше 2 %.
Дата добавления: 2015-02-28; просмотров: 4269;
