Виконання роботи
Оскільки титрування кислот основане на реакції нейтралізації, то гальванічний елемент складають із скляного електроду, який є індикатором на іони Н+, і хлоридно-срібного електроду порівняння.
Установка для потенціометричного титрування зображена на рис. 5.
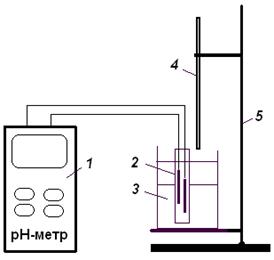
| Рис. 5. Схема установки для потенціометричного титрування: 1 – рН-метр; 2 – скляний комбінований електрод; 3 – стакан з розчином; 4 – бюретка; 5 – штатив. |
рН-Метр марки рН-150М призначений для потенціометричного вимірювання величини рН, окисно-відновного потенціалу (Eh, мВ) та температури водних розчинів.
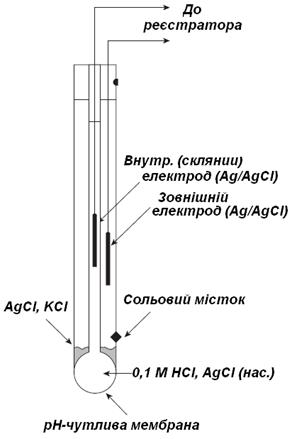
| Первинним перетворювачем є скляний комбінований електрод, потенціал якого залежить від концентрації (активності) іонів водню H+ та температури розчину. Скляний комбінований електрод, зображений на рис. 6, складається з двох електродів: вимірювального скляного (чутливий елемент ― поверхня скляної кульки) та порівняння - хлоридно-срібного. Рис. 6. Електрод скляний комбінований (ЕСК). |
Вимірювання рН.Вмикають прилад рН-150М в мережу електричного струму за допомогою блока живлення і готують його до роботи згідно з інструкцією.
Титрування суміші кислот. Заповнюють бюретку стандартним розчином NaOH. Наливають в чистий стакан досліджуваний розчин суміші кислот. Опускають в нього скляний комбінований електрод і додають дистильованої води стільки, щоб електрод був занурений в розчин приблизно на 2 см. На табло рН-метра висвітлюється початкове значення рН розчину, яке записують в таблицю.
Розчин NaOH додають з бюретки в стакан, перемішують протягом 5–10 с і вимірюють значення рН.
Розчин NaOH рекомендується додавати такими порціями:
по 0,5 мл до досягнення рН = 2,5–3;
по 0,1 мл в межах рН = 3–5,5;
по 0,5 мл в межах рН = 5,5–7,5;
по 0,1 мл в межах рН = 7,5–10;
по 0,5 мл в межах рН = 10–11.
Результати титрування заносять у таблицю і обчислюють ΔрН, ΔV, ΔpH/ΔV.
Таблиця
| V(NaOH), мл | рН | ΔрН | ΔV | ΔpH/ΔV |
За даними таблиці будують графіки в координатах рН – V та ΔpH/ΔV – V. За графіком знаходять об’єми NaOH (V1 та V2), що витрачаються на титрування досліджуваного розчину суміші кислот.
Розраховують вміст Н3РО4 і НСl в розчині, мг:
m(Н3РО4) = (V2 – V1) · С(NaOH) · M(Н3РО4),
V2 – V1 = V3,
m(НСl) = (V1 – V3) · С(NaOH) · M(HCl),
де V1 - об’єм NaOH, який витрачається на титрування НСl і Н3РО4 за І ступенем; V2 – об’єм NaOH, який витрачається на титрування НСl і Н3РО4 за І і ІІ ступенем; V3 – об’єм NaOH, який витрачається на титрування Н3РО4, як одноосновної кислоти; (V1 – V3) – об’єм NaOH, який витрачається на титрування НСl
Дата добавления: 2015-02-28; просмотров: 1920;
