АМПЕРОМЕТРИЧНЕ ТИТРУВАННЯ З ДВОМА ІНДИКАТОРНИМИ ЕЛЕКТРОДАМИ
При звичайному амперометричному титруванні тільки один з електродів є індикаторним – це мікроелектрод, що піддається поляризації. Другим електродом – макроелектродом служать електроди порівняння (каломельний, хлорсрібний, меркур-йодидний), потенціал яких постійний. Електродні реакції проходять на індикаторному мікроелектроді.
Якщо ж занурити в той самий розчин одночасно два платинових електроди однакового розміру і накласти на них постійну напругу, то при відповідно підібраних реагентах під час титрування буде змінюватися сила струму в ланцюзі, що є функцією накладеної напруги і залежить також від концентрації іонів, які беруть участь у титруванні.
При додаванні титранту в розчині проходять хімічні реакції, концентрації компонентів увесь час змінюються.
Електродні процес з двома індикаторними електродами можна порівняти зі звичайним електролізом. У електрогравіметричному методі на аноді, більш позитивно зарядженому електроді, може проходити електроокиснення. На катоді, потенціал якого менше, ніж анода – електровідновлення. Якщо напруга, що накладається, невелика і потенціали виділення іонів не досягнуті, електроліз не проходить взагалі. Струм у ланцюзі практично відсутній. Але на відміну від електрогравіметричного методу в біамперометрії використовуються мікроелектроди, а склад розчину весь час змінюється за рахунок проходження хімічної реакції.
Напругу розкладання в електрогравіметрії розраховуємо за рівнянням:
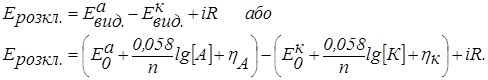
Якщо в розчині знаходяться дві солі FeSO4 і Fe2(SO4)3, то при електролізі проходять наступні електродні реакції:
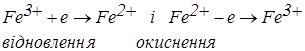
Тому що перенапруга для цих процесів дорівнює нулю, то напруга розкладання буде визначатися тільки опором у ланцюзі – величиною IR.
При знятті вольтамперних кривих солей FeSO4 і Fe2SO4 виходить зворотна катодно-анодна хвиля (рис. 5.16, кр. 3).
Як видно з наведених даних, крива 3, потенціал відновлення заліза (III) дорівнює потенціалу окиснення заліза (II). Такі сполучені пари називаються електрохімічно зворотними і їх використання перспективне в амперометричному титруванні з двома індикаторними електродами (біамперометрії).
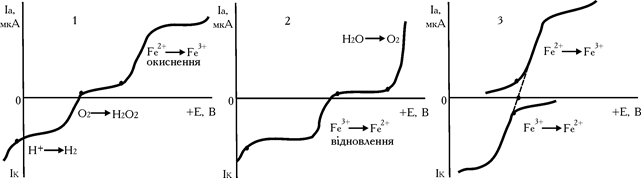
Рис. 6.16. Форма вольтамперних кривих розчинів FeSO4 (1) і Fe2(SO4)3 (2) і суміші FeSO4+Fe2(SO4)3 (3)
Розглянемо приклад титрування заліза (II) біхроматом калію. Хімічна реакція в розчині:
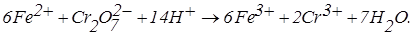
Електродні реакції на електродах при накладенні на них напруги 0,1 В (на подолання опору ланцюга):
У початковий момент в аналізованому розчині є тільки Fe2+. Сполученої пари ще немає. Струм практично дорівнює нулю. У процесі титрування  зменшується, а концентрація тривалентного заліза збільшується. Тобто, з'являється окисно-відновна електрохімічно зворотна пара,
зменшується, а концентрація тривалентного заліза збільшується. Тобто, з'являється окисно-відновна електрохімічно зворотна пара,  , концентрація якої росте. Якщо відтитровано, наприклад 10% двовалентного заліза, то з'явиться 10% Fe3+ і залишиться 90% Fe2+. Швидкість електролізу лімітується швидкістю транспортування іонів до електрода, швидкістю дифузії, що пропорційна інгредієнту концентрацій. У нашому прикладі, коли Fe3+ менше ніж Fe2+, швидкість електролізу і сила струму в ланцюзі лімітується концентрацією тривалентного заліза. В міру титрування кількість заліза (III) зростає і струм збільшується. Максимальне значення сили струму досягається в той момент, коли відтитровано 50% заліза (II) (рис. 6.17). Надалі концентрація Fe2+, що залишилась стає менше, ніж утворилося Fe3+ і лімітуючим швидкість електролізу стає двовалентне залізо. Струм зменшується. Коли все Fe2+ відтитровано біхроматом калію, зворотна пара зникає і струм знову практично дорівнює нулю.
, концентрація якої росте. Якщо відтитровано, наприклад 10% двовалентного заліза, то з'явиться 10% Fe3+ і залишиться 90% Fe2+. Швидкість електролізу лімітується швидкістю транспортування іонів до електрода, швидкістю дифузії, що пропорційна інгредієнту концентрацій. У нашому прикладі, коли Fe3+ менше ніж Fe2+, швидкість електролізу і сила струму в ланцюзі лімітується концентрацією тривалентного заліза. В міру титрування кількість заліза (III) зростає і струм збільшується. Максимальне значення сили струму досягається в той момент, коли відтитровано 50% заліза (II) (рис. 6.17). Надалі концентрація Fe2+, що залишилась стає менше, ніж утворилося Fe3+ і лімітуючим швидкість електролізу стає двовалентне залізо. Струм зменшується. Коли все Fe2+ відтитровано біхроматом калію, зворотна пара зникає і струм знову практично дорівнює нулю.
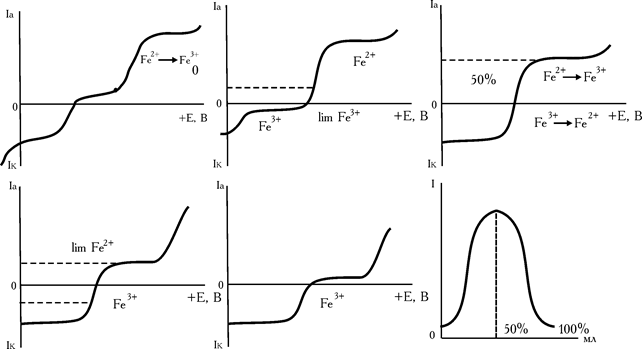
Рис. 6.17. Схематичні вольтамперні криві для різного ступеня відтитрованості Fe2+ біхроматом калію і крива титрування з двома індикаторними електродами
Крива титрування має вигляд симетричного дзвону («горба») (рис. 6.17).
До електрохімічно зворотних сполучених пар крім 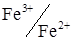 відносяться
відносяться  і деякі інші.
і деякі інші.
Практично титрування з двома індикаторними електродами можливе в будь-якому випадку, якщо прикладена напруга перевищує різницю катодного й анодного потенціалів, що встановлюються в умовах даного титрування. При виборі напруги знімають вольтамперні криві всіх «учасників» титрування, а іноді і всіх інших іонів, що є присутніми у розчині. Якщо для вибору потенціалу індикаторного електрода при звичайному амперометричному титруванні граничного струму катодного або анодного процесу (ділянки 1 і 2 на кривій рис. 6.18), то для вибору напруги при титруванні з двома індикаторними електродами важлива ділянка, що збігається з віссю абсцис (ділянка 3 на кривій рис. 6.18). Чим більше зворотність, тим менше довжина цієї ділянки і тим менше може бути прикладена напруга для того, щоб забезпечити катодний і анодний процеси на електродах. Накладена на електроди напруга постійна, але потенціали анода і катода в більшому або меншому ступені змінюються під час титрування. У випадку появи нової зворотної пари електродів змінюються досить рідко зі збереженням, що накладається, DЕ.
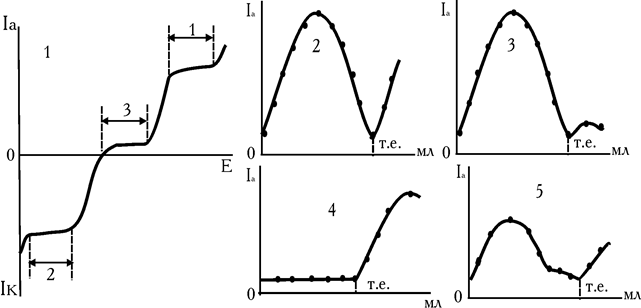
Рис. 6.18. Схематична вольамперна крива для необоротної окислювально-відновної пари (1). Форма кривих амперометричного титрування IrIV+RSH (2), K4Fe(CN)6+KMnО4 (3), Zn2++K4Fe(CN)6, (K3Fe(CN)6), Cu2++RSH на фоні KCl (5)
Якщо розглянути форми кривих амперометричного титрування з двома індикаторними електродами, їх можна розділити на такі типи в залежності від електрохімічних властивостей компонентів:
– титрування іонів, що утворюють у результаті окисно-відновної хімічної реакції в розчині зворотну пару, незворотною – колоколоподібні криві (рис. 6.17 і рис. 6.18, кр. 3);
– титрування електрохімічної незворотної пари – зворотною (зворотна пара з'являється після точки еквівалентності – ель-подібна крива (рис. 6.18, кр. 4);
– титрування зворотної пари – зворотною. Наприклад, йод-фероціанідом:
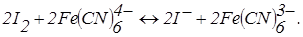
До точки еквівалентності «працює» пари 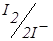 , що з'являється при додаванні першої порції титранту. Після точки еквівалентності в розчині накопичується K3Fe(CN)6 і з’являються надлишкові краплі K4Fe(CN)6. Виникає нова зворотна пара. Струм знову збільшується (рис. 6.18, кр. 2). Таким чином електродні реакції під час титрування можна записати так:
, що з'являється при додаванні першої порції титранту. Після точки еквівалентності в розчині накопичується K3Fe(CN)6 і з’являються надлишкові краплі K4Fe(CN)6. Виникає нова зворотна пара. Струм знову збільшується (рис. 6.18, кр. 2). Таким чином електродні реакції під час титрування можна записати так:
до точки еквівалентності:
 ,
,
після точки еквівалентності:
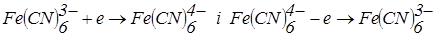 .
.
При проходженні в розчині реакцій осадження можливо штучне створення зворотної пари. Так для визначення цинку (II) фероціанідом у розчин перед титруванням додають декілька крапель розведеного розчину K3Fe(CN)6. Тоді після повного осадження цинку (II):
з'явиться надлишок K4Fe(CN)6 і внаслідок «роботи» пари 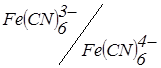 струм зростає.
струм зростає.
Для амперометричного титрування з двома індикаторними електродами використовують і сірковмісні органічні сполуки. Використання останніх значно розширило можливість застосування амперометричного титрування з двома індикаторними електродами.
Більшість сірковмісних реагентів диетілдитіокарбамінат, 8-меркаптохінолін та ін., утворюють у водних розчинах «змішані» електрохімічно зворотні пари О2 розчинні у Н2О/RSH (рис. 19, кр. 1). Системи  електрохімічно не зворотні. Змішаними електрохімічно зворотними парами називаються системи, утворені з компонентів різної природи, у яких потенціал відновлення однієї речовини збігається з потенціалом окиснювання іншої.
електрохімічно не зворотні. Змішаними електрохімічно зворотними парами називаються системи, утворені з компонентів різної природи, у яких потенціал відновлення однієї речовини збігається з потенціалом окиснювання іншої.
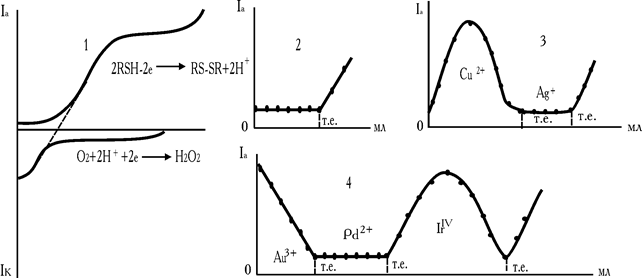
Рис. 6.19. Анодно-катодна хвиля “змішаної” пари О2/RSH (1), криві амперометричного титрування Ni2+ (Cd2+, Zn2+) розчином RSH (2), послідовне титрування срібла (I) і міді (II), Au3++Pd2+IrIV (4) 8-меркаптохіноліном
У розчинах, що містять кілька компонентів, як уже відзначалося, із сірковмісними компонентами можуть послідовно проходити реакції осадження і комплексоутворення. Таке сполучення можливе і для одного метало-іона перемінного ступеня окиснювання. Так при титруванні міді (II) на фоні KCl спочатку проходить відновлення міді (II) до одновалентної, а потім осадження різнолігандної малорозчинної сполуки

Крива такого титрування наведена на рис. 18, кр. 5.
На двох індикаторних електродах можливі так само послідовні титрування, наприклад срібла (AgCl2–) і міді (II) на фоні KCl. Початку реакції з міддю відповідає різка зміна струму в зв'язку з появою зворотної сполученої пари 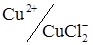 (рис. 6.19, кр. 3).
(рис. 6.19, кр. 3).
Приклади титрування трикомпонентної композиції наведені на рис. 19, кр 4. У розчині з 8-меркаптохіноліном послідовно взаємодіє золото (III), паладій (II) і іридій (IV). Високий струм спочатку титрування обумовлюється наявністю зворотної змішаної пари 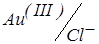 . В міру зменшення концентрації Au3+, струм зменшується, а CCl– практично залишається постійним.
. В міру зменшення концентрації Au3+, струм зменшується, а CCl– практично залишається постійним.
Дата добавления: 2015-03-19; просмотров: 1445;
