Методика виконання роботи. Перед титруванням знаходять потенціал електрохімічного окиснювання K4Fe(CN)6
Перед титруванням знаходять потенціал електрохімічного окиснювання K4Fe(CN)6. Для цього знімають вольтамперну криву фероціаніду. Промивають Pt мікроелектрод у HNO3 (1:1) і Н2О. У електролізер вводять 1 мл титранту, додають 30 мл фонового електроліту, замикають ланцюг, включають електромотор, що обертає робочий мікроелектрод, і поступово змінюючи зовнішню ЕРС в інтервалі 0–1,4 В через кожні 0,2 В, реєструють показання мікроамперметра. Будують на міліметровому папері функціональну залежність I–E і вибирають значення потенціалу, що відповідає граничному струму окиснювання K4Fe(CN)6.
Заданий об’єм аналізованого розчину CdSO4 (ZnSO4) поміщають у мірну колбу місткістю 50 мл, розчин розбавляють дистильованою водою до мітки, перемішують. Заповнюють мікробюретку розчином K4Fe(CN)6. У стаканчик для титрування (електролізер) відбирають піпеткою 5 мл розведеного аналізованого розчину, 30 мл фонового електроліту, занурюють електроди, включають електромотор, встановлюють потенціал, що відповідає граничному струму окиснювання титранту і титрують розчином K4Fe(CN)6, додаючи його порціями по 0,1 мл. Реєструють показання мікроамперметра після кожного додавання реактиву. Титрування проводять 2–3 рази. За результатами титрування, зведеним у таблицю (табл. 7.4) будують криву в координатах 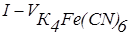 . По злому на цій кривій визначають об’єм розчину K4Fe(CN)6, що відповідає точці еквівалентності. Розраховують масу Cd2+ (Zn2+) у задачі за формулою
. По злому на цій кривій визначають об’єм розчину K4Fe(CN)6, що відповідає точці еквівалентності. Розраховують масу Cd2+ (Zn2+) у задачі за формулою
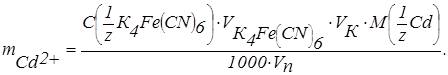
Таблиця 7.4
| Додано, K4Fe(CN)6, мл | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | 1,0 |
| Показання мікрогальванометра (ділення шкали) | … | … | … | … | … | … | … | … |
7.2. Визначення свинцю в технічному Pb(NO3)2
Дата добавления: 2015-03-19; просмотров: 661;
