ПОСЛІДОВНІ (ДИФЕРЕНЦІЙОВАНІ) ТИТРУВАННЯ
До переваг амперометрії варто віднести і можливість послідовного титрування, що дозволяє визначити кілька компонентів за одну операцію.
Для диференційованих титрувань необхідне виконання двох умов:
– визначувані компоненти повинні реагувати з титрантом послідовно;
– електрохімічні властивості визначуваних речовин, проміжних продуктів, титранту або продуктів реакції повинні забезпечувати фіксацію точок еквівалентності.
Класичним прикладом визначення елементів двокомпонентної суміші є титрування барію (II) і свинцю (III) біхроматом калію. У розчині послідовно перебігають наступні хімічні реакції осадження:
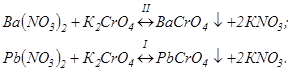
Добуток розчинності сполук, що утворюються, дорівнюють 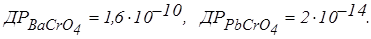 Виходить, першим в осад випадає хромат свинцю, а другим, після зв'язування Pb2+ – хромат барію.
Виходить, першим в осад випадає хромат свинцю, а другим, після зв'язування Pb2+ – хромат барію.
Електрохімічно активні Pb2+ і CrО42–, що при напрузі –1,0 В відновлюються на ртутно-крапельному електроді.
Електродні мікропроцеси:
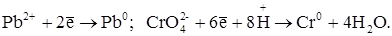
На кривій титрування (рис. 5.12, кр.1) фіксуються два чітких перегини. Напочатку титрування катодний струм високий, тому що в розчині (Ba2++Pb2+) знаходиться свинець (II), що дає електродну реакцію. При титруванні струм зменшується. Коли весь свинець (II) буде зв'язаний в осад, титрант взаємодіє з Ва2+. Цьому хімічному процесу відповідає горизонтальна площадка. Після точки еквівалентності для барію (II) з'являється надлишок K2CrО4, що відновлюється на мікрокатоді. Струм різко зростає.
Використовуючи в якості титранта тіокарбамід можна диференційовано визначити ртуть (II) і срібло (I). Комплексна сполука Hg2+ з тіокарбамідом прочніше ніж з Ag+. Величини констант стійкості цих продуктів відрізняються один від одного на десять порядків. Тому при титруванні спочатку утворюється тіокарбамід ртуті (II), а потім із ТК реагує срібло.

Рис. 5.12. Криві диференційованого титрування Pb2+ і Ba2+ розчином K2CrO4 (I) і суміші Hg2++Ag+ розчином тіокарбаміда
Хімічні реакції в розчині мають вигляд:
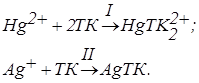
Крива амперометричного титрування срібла має аномальний колоколообразний вигляд. При напрузі 0,8–1,0 В на платиновому мікроаноді окиснюється проміжний продукт взаємодії срібла з тіокарбамідом.
Електродні реакції мікроокиснювання:
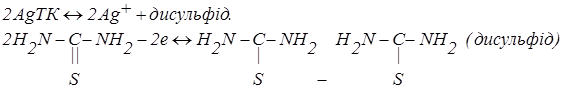
Крива титрування з голяду на вищевикладене повинна мати вигляд, наведений на рис. 5.12, кр.2.
Для двокомпонентних систем теоретично можна представити більш 10 кривих у залежності від електрохімічних властивостей компонентів (рис. 5.13). Які речовини електрохімічно активні для кожної кривої?
Практично їх набагато менше.
При титруванні двокомпонентних сполучень іноді використовують 2 титранта, відомі варіанти титрувань одним розчином, що титрує, але зі зміною кислотності середовища і титрування зі зміною потенціалу, що накладається.
Наприклад, мідь (II) і свинець (II) можуть бути кількісно визначені на ртутно-крапельному електроді при потенціалі поляризації –0,7 В сульфат-іонами й антраніловою кислотою. Спочатку осаджується сульфат свинцю, а потім антраніловою кислотою титрують мідь.
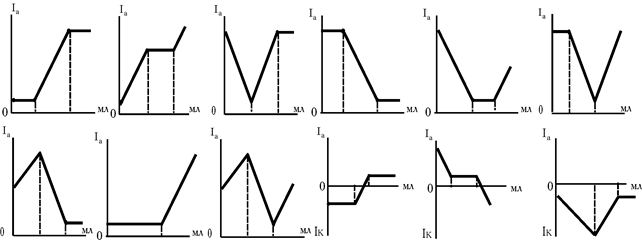
Рис. 5.13. Теоретично можливі типи кривих титрування двокомпонентних сумішей: (А+У)+R®А’+B’, у залежності від їх електрохімічних властивостей
Крива титрування носить ступінчастий характер (рис. 5.14, кр.1). Для наведеного приклада електроактивні Рb2+ і Сu2+.

Рис. 5.14. Форма кривих послідовного титрування сумішей Pb2+ і Cu2+ двома реагентами (1) і Ce4++Fe3+ аскорбіновою кислотою зі зміною кислотності розчину
Для визначення церію (IV) і заліза (III) аскорбіновою кислотою використовують залежність окислювально-відновного потенціалу аскорбіновою кислотою від кислотності середовища. Нормальний окислювально-відновний потенціал якої дорівнює 0,4 В. В 3М H2SO4 потенціал збільшується до 1,2 В. Окислювально-відновні потенціали 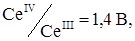 а
а 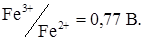 Отже на фоні H2SO4 аскорбінова кислота відновлює тільки церій. Після фіксації точки еквівалентності для СеIV, середовище нейтралізують і дотитровують залізо. При чому титрування церію (IV) проводять при потенціалі поляризації мікроелектрода +0,3 В (церій електрохімічно активний), а для заліза напруга, що накладається, +0,1 В. При нейтралізації і зміні напруги, що накладається, струм відновлення заліза трохи зменшується (рис. 5.14, кр.2, т. А).
Отже на фоні H2SO4 аскорбінова кислота відновлює тільки церій. Після фіксації точки еквівалентності для СеIV, середовище нейтралізують і дотитровують залізо. При чому титрування церію (IV) проводять при потенціалі поляризації мікроелектрода +0,3 В (церій електрохімічно активний), а для заліза напруга, що накладається, +0,1 В. При нейтралізації і зміні напруги, що накладається, струм відновлення заліза трохи зменшується (рис. 5.14, кр.2, т. А).
Амперометричним титруванням можливо здійснити визначення трьох і навіть чотирьох компонентів за одну операцію. Для таких складних титрувань використовують сірковмісні реагенти, що мають дуалізм властивостей. Як уже відзначалося це, ті реагенти, які мають властивості комплексоутворюючого ліганда і є відновниками середньої сили.
При титруванні різних сумішей у розчині можуть послідовно перебігати реакції осадження та окиснювання-відновлення. Наприклад, для трикомпонентної суміші Pd2++Ir і Cu2+ (PdCl42––IrCl62– і Cu2+) 8-меркаптохіноліном першим осаджуються іони паладію ( 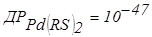 ), потім RSH відновлює іридій і тільки наприкінці – осаджує іони міді (
), потім RSH відновлює іридій і тільки наприкінці – осаджує іони міді ( 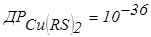 ).
).
Хімічні реакції в розчині:
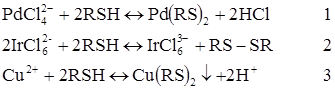
При напрузі, що накладається, рівній +1 В електрохімічно активні 8-меркаптохінолін і тривалентний іридій – продукт другої реакції.
Електрохімічні мікропроцеси окиснювання на електроді:
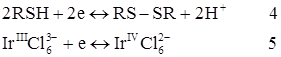
З огляду на вищевикладені факти у випадку титрування розглянутої суміші на початку повинна фіксуватися горизонтальна площадка, потім струм буде рости за рахунок окиснювання продукту реакції 2-тривалентного іридію (продукту другої реакції), і, нарешті осадженню міді буде відповідати друга горизонтальна площадка. Після точки еквівалентності міді з'явиться надлишок титранту, що теж окиснюється на мікроаноді (рис. 5.15, кр. 1).
Аналогічні явища спостерігаються і при визначенні компонентів тривалентної суміші: VV+Fe3++Cu2+. Завдяки окиснюванню на мікроаноді продукту окисно-відновної реакції
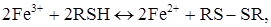
-іонів двовалентного заліза, після взаємодії RSH з ванадієм, струм росте. А окиснювання надлишку титранта дозволяє зафіксувати точку еквівалентності для міді. Крива титрування системи VV–Fe3+–Cu2+ наведена на рис. 15, кр. 2.
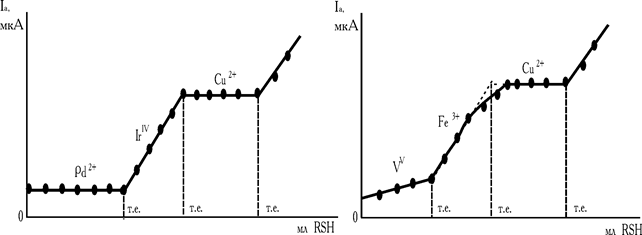
Рис. 5.15. Форма кривих амперометричного диференційованого титрування трикомпонентних сумішей розчином 8-меркаптохіноліну
Дата добавления: 2015-03-19; просмотров: 850;
