Амперометричне титрування
Полярографічний (вольтамперометричний) метод аналізу ґрунтується на вимірюванні параметрів поляризаційних (вольтамперних) кривих (кривих залежності сили струму від напруги), які одержуються при електролізі розчину досліджуваної речовини в умовах поляризації одного з електродів. Процес відбувається при поступовому підвищенні напруги з фіксацією сили струму. Для створення умов одержання вольтамперних кривих необхідно, щоб один з електродів мав малу поверхню (легко поляризувався) — наприклад, ртутний краплинний електрод (РКЕ) або твердий мікроелектрод (платиновий, графітовий та ін.). На цьому електроді відбувається електровідновлення або електроокиснення речовини. Другий електрод — з великою поверхнею (не поляризується) — шар ртуті на дні електролізера або насичений каломельний електрод (НКЕ). І, нарешті, електроліз повинен відбуватися на фоні індиферентного електроліту, концентрація якого має бути більшою від концентрації досліджуваної речовини в десятки-сотні разів. Зміна зовнішньої електрорушійної сили (ЕРС) в такій системі буде повністю йти на зміну потенціалу поляризованого електрода (Е).
Поляризація, або відхилення початкового рівноважного потенціалу електрода, зумовлена протіканням електричного струму на межі розчин-електрод і, як наслідок, зміною природи поверхні електрода внаслідок осідання продуктів електролізу (хімічна поляризація) та зменшенням концентрації аналізованої речовини біля поверхні електрода (концентраційна поляризація). Деколи має місце ще один вид поляризації — перенапруження або електрохімічна поляризація.
Аналітичним сигналом в полярографічних методах аналізу є полярограма (вольтамперна крива), на форму якої найбільший вплив має концентраційна поляризація. Вплив інших видів поляризації повинен бути зменшений до мінімуму.
Розчини речовин (йонів), що знаходяться в електролітичній комірці і здатні брати участь в електродних реакціях, називаються деполяризаторами.
Розглянемо вольтамперну криву (рис. 1), одержану в присутності йонів металу Меn+, які відновлюються на ртутному краплинному електроді (РКЕ) з утворенням амальгами:
Меn+ + ne– + Hgo ¾® Meo(Hgo) (1)
При малому потенціалі на катоді реакція відновлення відбуватися не може, однак, через електролітичну комірку все-таки протікає невеликий струм, який називається залишковим струмом (Ізал). Складовими частинами цього струму є конденсаторний струм, що йде на створення подвійного електричного шару на поверхні краплі, струм на відновлення більш електроактивних мікродомішок та міґраційний струм.
При збільшенні потенціалу на РКЕ до величини потенціалу відновлення (Ев) починають розряджатися йони деполяризатора і сила струму в колі починає зростати, а концентрація йонів біля поверхні краплі зменшуватися. Однак за рахунок дифузії з маси розчину в приповерхневий шар поступають нові порції йонів. Таким чином, сила струму в колі буде залежати від швидкості дифузії, яка в свою чергу пропорційна різниці концентрацій в масі розчину Со та в приелектродному шарі С, тобто
І = К×(Со – С) (2),
де К — коефіцієнт пропорційності.
При деякому потенціалі на катоді концентрація йонів деполяризатора біля поверхні ртутної краплі С зменшиться до мізерно малої порівняно з концентрацією в масі розчину, а швидкість дифузії досягне найбільшого гранично можливого значення. Очевидно, сила струму, контрольована дифузією, також досягне граничної величини Ід при даній концентрації Со йонів у розчині:
Ід = К×Со (3),
де Ід — сила дифузійного струму.
Одночасно може мати місце недифузійний процес міґрації йонів до катода під дією електричного поля. Внаслідок цього виникає міґраційний струм Ім, який додається до дифузійного, і сумарний струм стає при цьому не пропорційним концентрації. Для зменшення сили міґраційного струму в розчин вводять у достатній кількості індиферентний (фоновий) електроліт, йони якого мають значно більш від’ємний потенціал відновлення, ніж у деполяризатора. Катіони фонового електроліту екранують електрод, зменшуючи таким чином до нуля рушійну силу міґрації під дією електричного поля.
Концентрація йонів деполяризатора в глибині розчину Со практично постійна, оскільки електроліз протікає при дуже малій силі струму (порядку 10–6 А), а тому швидкість дифузії при постійній температурі та постійному складі всіх компонентів у розчині залишається сталою, тобто наступає стан рівноваги, який характеризується постійною граничною силою струму Ігр, що майже не змінюється при дальшому зростанні напруги.
Типова залежність сили струму від прикладеної напруги набуває вигляду кривої, показаної на рисунку 1, яку називають полярографічною хвилею.
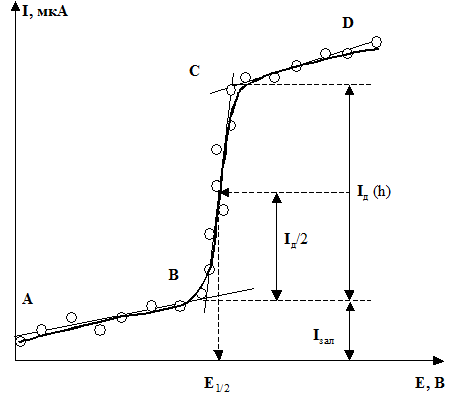
Рис. 1. Катодна вольтамперна крива (полярографічна хвиля)
З полярограми, шляхом проведення ліній через початкову ділянку кривої (АВ), ділянку перегину (ВС) та кінцеву ділянку (СD) до взаємного перетину, як це показано на рисунку, можна знайти величину залишкового Ізал та дифузійного Ід струмів.
З рівняння Нернста виводиться рівняння полярографічної хвилі:
Е = Е½ – 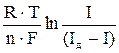 (4),
(4),
де Е½ — потенціал півхвилі, який є якісною характеристикою йона в розчині даного фонового електроліту, В;
R— універсальна газова стала, 8.312 Дж/(моль×град) ;
Т — абсолютна температура, К;
F— стала Фарадея, 96500 Кл/моль;
n — число електронів, що беруть участь в електродній реакції.
Ця залежність має назву рівняння Гейровського-Ільковича. Потенціал півхвилі залежить від природи визначуваної речовини, складу фонового електроліту, рН розчину, а висота хвилі – від концентрації визначуваної речовини.
На полярограмах нерідко виникають максимуми різної форми, які заважають визначенню істинної величини потенціалу півхвилі та сили дифузійного струму. Максимуми І-го роду мають форму гострих піків, які з’являються в розведених розчинах та викликані нерівномірною поляризацією поверхні ртутної краплі. Максимуми ІІ-го роду мають форму заокруглених піків, які з’являються в концентрованих розчинах при швидкому витіканні ртуті з капіляру. Для усунення максимумів в досліджуваний розчин вводять поверхнево-активні полімерні речовини: желатин, аґар-аґар, полівініловий спирт, поліакриламід та інші.
Полярографічний метод аналізу відзначається швидким виконанням, низькою межею виявлення (до 10–5...10–6 моль/л), можливістю визначення декількох компонентів в одному розчині при умові, що їх потенціали відновлення відрізняються не менше, ніж на 0,2 В. Можливе також визначення органічних речовин, здатних окиснюватися або відновлюватися на поверхні електродів.
Методичні вказівки містять описи установок, приладів та пристроїв, необхідних при виконанні лабораторних робіт, та методики виконання шести лабораторних робіт. Для підготовки до лабораторних занять слід користуватися літературою, список якої наведений в кінці вказівок, та конспектом лекцій.
Дата добавления: 2015-02-28; просмотров: 1407;
