Якісне визначення катіонів металів
Мета роботи — ідентифікація катіонів у розчині. Очевидно, для цього необхідно експериментально зняти вольтамперну криву шляхом вимірювання сили струму, що протікає через електролізер, при зростанні напруги на електродах.
Реактиви, посуд та прилади
1. Розчини, які містять невідомі визначувані катіони важких металів.
2. Фонові електроліти: 1 М розчин KCl або 0.1 М НCl.
3. 0.1 %-й розчин желатину.
4. Піпетки на 10 і 5 мл.
5. Електролізер — стаканчик на 40–50 мл.
6. Електроди НКЕ та РКЕ на штативі.
7. Електролітичний місток, заповнений насиченим розчином KCl.
8. Полярограф.
Методика виконання роботи.
Роботу можна виконувати на приладах з візуальним способом запису полярограм у такій послідовності:
1. Ввімкнути та підготувати прилад до вимірювання за методикою, описаною в інструкції.
2. Одержати у викладача досліджуваний розчин, записати склад та концентрацію фонового електроліту.
3. Зібрати електролітичну комірку, зануривши в стаканчик електроди та сольовий місток (електролітичний ключ).
4. Провести вимірювання за методикою, описаною в інструкції. Результати вимірювань записати у табл. 2.
Таблиця 2
| № п/п | Напруга по лімбу реохорда Е, В | Сила струму з ґальванометра Іо, поділок | І = Іо – Ізал | Ід – І | 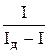
| lg 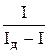
|
| ... |
5. Про закінчення вимірювань повідомити викладача, опустити резервуар з ртуттю вниз. Розчин з відпрацьованою ртуттю із стаканчика-електролізера вилити в стакан (банку) для зливу ртуті, закривши її годинниковим склом чи кришкою. РКЕ, сольовий місток і стаканчик-електролізер промити дистильованою водою, яку потім вилити в посудину з відпрацьованою ртуттю. Сольовий місток помістити в стакан з розчином KCl. РКЕ залишити в стаканчику-електролізері, наливши в нього дистильованої води, або закріпити електрод на штативі нижнім кінцем вгору, якщо це передбачено конструкцією установки.
Обробка одержаних даних та складання звіту
За даними, записаними в перших двох стовпчиках табл. 2, побудувати на міліметровому папері вольтамперну криву (на осі абсцис — Е, на осі ординат — Іо). З графіка визначити наближене значення Е½, а також величину залишкового Ізал та дифузійного Ід струмів.
Провести обчислення в 4, 5, 6 і 7 стовпчиках (табл. 2). Очевидно, початкові точки, для яких значення І від’ємні, та кінцеві точки, для яких значення Ід – І також від’ємні, з розрахунків вилучають і в таблицю не поміщають.
Розмістити в координатах (E — вісь абсцис, lg (І/(Ід – І)) — вісь ординат) (рис. 3) точки, для яких існують значення в 2 і 7 стовпчиках таблиці, провести через них, згідно з правилом, пряму лінію, яка буде відтинати на осі абсцис точне значення потенціалу півхвилі Е½ (число точок зліва від прямої приблизно дорівнює числу точок справа).
Розрахувати величину котангенса кута нахилу прямої до осі абсцис та визначити число електронів n, що брали участь в електродній реакції
n = 0.059/ctg α.
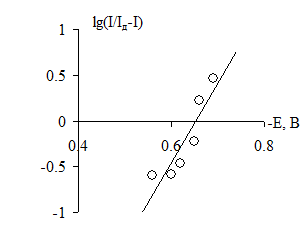
Рис. 3. Вольтамперна крива в напівлогарифмічних координатах
Звіт повинен містити: назву роботи, короткий опис теоретичних основ методу дослідження та способу вимірювання, характеристику досліджуваних або використовуваних як допоміжні розчинів, результати спостережень (табл. 2) та обробки експериментальних даних.
В кінці звіту, на основі знайдених Е½ та n, повинен бути обґрунтований висновок про якісний склад досліджуваного розчину.
Дата добавления: 2015-02-28; просмотров: 1118;
