ЯКІСНИЙ ПОЛЯРОГРАФІЧНИЙ АНАЛІЗ
Якісний полярографічний аналіз ґрунтується на вимірюванні потенціалу півхвилі речовини (йона), що відновлюється. Потенціалом півхвилі називається потенціал, при якому досягається величина сили струму, що дорівнює половині сили граничного дифузійного струму (точка Е½ на рис. 1). Потенціал півхвилі залежить від природи відновлюваної речовини (йона), природи та концентрації фонового електроліту, рН середовища і не залежить від концентрації визначуваної речовини. Величини потенціалів півхвилі різних речовин, визначені експериментально в найчастіше вживаних фонових електролітах, занесені в таблиці (наприклад, табл. 1), якими й користуються для ідентифікації речовин.
Якщо в розчині присутні декілька йонів з різними потенціалами півхвиль, що відрізняються більше ніж на 0.2 В, то кожен з йонів буде давати на полярографічній кривій свою власну характерну хвилю і полярограма матиме вигляд ступінчастої кривої.
Потенціал півхвилі може бути визначений двома способами:
1. Після побудови полярографічної кривої в координатах І – Е, шляхом проведення дотичних ліній через ділянку залишкових струмів (АВ), ділянку хвилі (ВС) та ділянку граничних струмів (СD) до їх взаємного перетину, знаходять висоту хвилі h або Ід, як показано на рис. 1. Знаходять на кривій точку, що відповідає половині висоти хвилі, і опускають перпендикуляр на вісь Е. Перетин перпендикуляра з віссю вказує наближену величину потенціалу півхвилі Е½.
2. Точніше потенціал півхвилі можна визначити, користуючись рівнянням полярографічної хвилі Гейровського-Ільковича:
Е = Е½ – 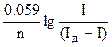 (5),
(5),
де Е — потенціал в будь-якій точці ділянки хвилі, В;
І — сила струму при потенціалі Е;
Е½ — потенціал півхвилі, В;
Ід — сила граничного дифузійного струму;
n — число електронів, що беруть участь в електродній реакції.
У напівлогарифмічних координатах — це рівняння прямої лінії, яка перетинає вісь абсцис у точці Е½ (рис. 3). Кут нахилу прямої визначається коефіцієнтом (0.059/n) = ctg α, звідки можна визначити n.
Таблиця 1
Потенціали півхвилі на РКЕ (по відношенню до НКЕ)
деяких йонів та молекул
| Назва катіонів або молекул | 1 М KCl | 0.1 M HCl | 1 M NaOH | 1 М NH4OH + 1 M NH4Cl | 1 М NH4OH + 1 M NH4Cl + етанол 50% |
| Манґан (ІІ) | –1,55 | –1,55 | –1,70 | –1,54 | — |
| Кобальт (ІІ) | –1,23 | –1,20 | — | –1,32 | — |
| Нікель (ІІ) | –1,10 | –1,10 | — | –1,06 | — |
| Цинк (ІІ) | –1,02 | –0,995 | –1,49 | –1,33 | — |
| Кадмій (ІІ) | –0,64 | –0,60 | –0,78 | –0,81 | — |
| Станум (ІІ) | — | –0,46 | –1,22 | — | — |
| Станум (ІV) | — | — | — | –0,25 –0,52 | — |
| Плюмбум (ІІ) | –0,43 | –0,40 | –0,76 | — | — |
| Купрум (ІІ) | –0,02 | — | –0,25 | — | |
| Хром (ІІІ) | –0,81 –1,50 | — | — | — | — |
| Хром (VI) | –0,3 | — | –0,85 | –0,46 | — |
| Водень (І) | –1,58 | –1,58 | — | — | — |
| Кисень (0) | –0,05 | –0,05 | –0,94 | — | — |
| Ацетофенон | — | — | –0,98 | — | –1,48 |
| Бензофенон | — | — | –0,75 | — | –1,34 |
| Ацетон | — | — | — | — | –0,35 |
| Нікотинова к-та | — | — | — | — | –1,12 |
Дата добавления: 2015-02-28; просмотров: 2175;
