ВИЗНАЧЕННЯ ВМІСТУ КРИСТАЛІЗАЦІЙНОЇ ВОДИ В КРИСТАЛОГІДРАТАХ
В системах автоматического контроля исполнительное устройство служит для сигнализации, индикации, регистрации, защиты и т.д. Примерами могут служить сирены, сигнальные лампы, измерительные приборы, отключающие устройства системы защиты и др.
В системах автоматического управления и регулирования исполнительные элементы служат для изменения регулирующего воздействия в соответствии с сигналом, подаваемым на его вход от управляющего устройства. Исполнительные элементы в основном бывают двух типов: с механическим выходом (сервомотор, сервопривод), когда исполнительный элемент производит механическое перемещение регулирующего органа, и с электрическим выходом, когда воздействие, непосредственно прикладываемое к объекту регулирования, имеет электрическую природу.
В исполнительных элементах первого типа используются муфты, электромагниты, электродвигатели (сервоэлектродвигатели), пневматические и гидравлические серводвигатели, насосы и др.
В элементах второго типа используются контакторы, регулируемые реостаты, конденсаторы с переменной емкостью, регулируемые трансформаторы, электрические реле, дроссели насыщения и др.
Для управления исполнительным элементом применяются усилители мощности. По виду используемой энергии исполнительные элементы делятся на электрические, механические, гидравлические, пневматические и комбинированные.
ВИЗНАЧЕННЯ ВМІСТУ КРИСТАЛІЗАЦІЙНОЇ ВОДИ В КРИСТАЛОГІДРАТАХ
МЕТА: Навчитися користуватися аналітичною вагою, проводити аналіз зміни маси речовини при дегідратації, оцінювати структурні зміни кристалів.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Багато уявлень про механізми і кінетику топохімічних реакцій у багатьох випадках базуються на експериментальному дослідженні процесів дегідратації кристалогідратів, оскільки ці процеси є зручною модельною системою, яку можна використати для вивчення закономірностей термічного розкладу типу
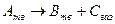 .
.
Крім цього, вивчення цих процесів має і прикладний інтерес, оскільки багато реакцій дегідратації використовуються у хімічній технології, технології будівельних матеріалів, в металургії тощо.
Використовуючи сучасні уявлення про кінетику і механізми хімічних перетворень у твердій фазі, процеси при дегідратації кристалогідратів можуть бути поділені на три групи:
1) процеси, пов’язані з виникненням зародків продуктів реакції;
2) утворення і ріст реакційних ядер;
3) сумарна кінетика процесу і сумарний механізм реакції.
Розглянемо їх докладніше.
Реакція дегідратації є оборотною, а це означає, що початок її зародження є малоімовірним у глибині кристала. Навіть якби це сталося, то через велику дифузійну протидію у місці виникнення реакції в кінці кінців встановився би рівноважний тиск і реакція припиняється. Тому молекули води, випаровуючись з поверхні у тих місцях, де вони найменше зв’язані з кристалом (точкові дефекти, домішки, дислокації тощо), будуть утворювати вакансії. Утворення зародків буде відбуватися у такому випадку у результаті міграції молекул води поверхнею і випаровування її у тих місцях, де на більш ранніх етапах вже утворилися вакансії. Ця модель є справедливою для більшості кристалогідратів, однак ряд експериментальних фактів вона не пояснює.
Кінетика розвитку та росту зародків вивчена більш досконало. Хоча і встановлено, що перший зародок на різних монокристалах однієї і тієї ж речовини утворюється у різний час, але криві «число зародків – час» (рис.1) мають плавний характер. Їх можна описати залежністю.
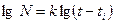 ,
,
де ti – час появи першого зародка. Наявність такої залежності дозволяє запропонувати наступне. Хоча поява першого зародку є, найімовірніше, випадковим процесом, який залежить від багатьох факторів, у подальшому в кристалі відбуваються незворотні зміни, які визначають появу другого, потім третього і т.д. зародків.
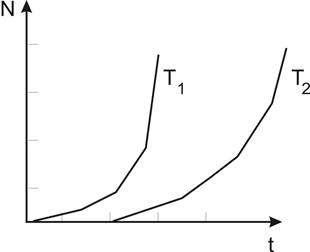
Рис.1.
Криві залежності кількості зародків від часу для різних температур, T1>T2
На кінетику дегідратації впливає ряд факторів:
1. Самоохолодження. Всі досліджені кристалогідрати втрачають воду з великим ендотермічним ефектом. Це призводить до того, що при дегідратації у вакуумі, к оли теплообмін зразка з термостатом здійснюється, в основному, через випромінювання, температура, при якій відбувається від’єднання молекули води, може і не дорівнювати температурі термостата. Для дегідратації CuSO4∙5H2O, виходячи з теорії випромінювання абсолютно чорного тіла та фізичних характеристик кристалів мідного купоросу, Смітом і Топлі виведена формула для розрахунку реальної температури кристала:
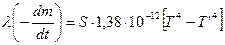 ,
,
де λ – тепловий ефект реакції,
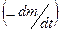 - масова швидкість реакції,
- масова швидкість реакції,
S – зовнішня поверхня зразка,
Т, Т’ – температури термостата і зразка відповідно.
Ефект самоохолодження навіть при незначній температурі термостата (наприклад, 15 оС) значно перевищує загальноприйняті межі стабілізації температури у ізотермічному процесі. Нехтування цим ефектом може призвести до суттєвих похибок при визначенні кінетичних параметрів реакції.
2. Вплив газової атмосфери. Газова атмосфера, в оточенні якої відбувається дегідратація кристалогідратів, може бути інертна чи містити пари води. Інертна атмосфера до тисків 400÷550 Па не впливає суттєво на швидкість дегідратації. Вищі тиски починають створювати дифузійну протидію і впливати на процес. Характер такого впливу встановити дуже важко, оскільки на цей ефект накладаються інші і виділити його у чистому вигляді практично неможливо.
Присутність пари води в реакційній зоні суттєво впливає на швидкість дегідратації. По-перше, це викликано тим, що швидкість цієї реакції визначається різницею швидкостей прямої та зворотньої реакцій диссоціації. По-друге, ці протилежні швидкості самі залежать від концентрації молекул у реакційній зоні. Остання ж визначається адсорбційною рівновагою. Тому співвідношення між константою швидкості реакції (чи швидкістю) і парціальним тиском води є складною залежністю. Залежність ускладнюється ще і тим, що пара води може проводити каталітичну дію як на процес дегідратації, так і на наступний процес кристалізації продукту.
Існування газового каталізу доведено на прикладі CuSO4∙5H2O. При вивченні дегідратації у потоці водню з малим вмістом водяної пари та хлоридної кислоти встановлено, що реакція пришвидшується у 5-7 разів. Причому хлоридна кислота адсорбувалася поверхнею кристалів.
3. «Імпеданс» шару продукту. При поширенні реакції в глибину кристала товщина шару продукту може стати такою, що виникнуть дифузійні труднощі для видалення молекул води в оточуючий простір з поверхні розділу фаз, яка є одночасно і місцем протікання реакції. Величина цього ефекту, який отримав назву «імпеданс», вимірюється як різниця між спостережуваною швидкістю руху межі розділу у глибину кристала і тією ж швидкістю при нульовій товщині шару, яка визначається екстраполяційними методами.
«Імпеданс» є комплексним явищем, оскільки на нього впливають багато факторів. Питання в першу чергу полягає в тому, у якій області – кінетичній чи дифузійній – протікає реакція. Також важливим є врахування зміни теплових потоків, які підводяться до зони реакції, тому що вихідна речовина і продукт реакції мають різні теплопровідності.
Дегідратація кристалогідратів іде через утворення проміжних аморфних чи кристалічних нижчих гідратів. Це і визначатиме можливі схеми розкладу.
Одним з найбільш повно вивчених у цьому плані серед кристалогідратів є пентагідрат CuSO4∙5H2O. Якщо реакція протікає в одну стадію, наприклад, з пентагідрата у моногідрат, то її можна представити за допомогою схеми, поданої на рис.2.
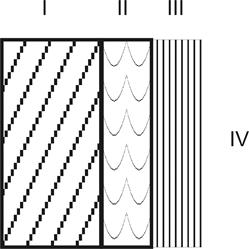
Рис.2.
Схема дегідратації кристалогідратів.
І – реагент
ІІ – область протікання реакції,
ІІІ – продукт реакції,
ІV – вакуум чи газова атмосфера
Враховуючи структуру CuSO4∙5H2O, обезводнювання у вакуумі йде завжди до моногідрата і відповідає втраті 4 молекул води, які координують з атомом Купруму. П’ята молекула води не координаційна і тому відрізняється за міцністю зв’язку.
У присутності пари води картина розкладу помітно ускладнюється, причому за рахунок появи тригідрата, як проміжної сполуки. Таким чином, загальна схема дегідратації пентагідрата Сульфата Купруму може бути представлена у вигляді
Аморфний тригідрат, який утворюється при розкладі у вакуумі відразу втрачає ще дві молекули води (шлях І), перетворюючись у моногідрат. Присутність пари води може направити реакцію шляхом ІІÞІІІ, оскільки вода сприяє кристалізації аморфного тригідрата.
Енергія активації для дегідратації CuSO4∙5H2O і CuSO4∙3H2O дорівнюють відповідно Е1=16÷18 ккал/моль і Е2=15,6 ккал/моль, тобто не відрізняються принципово.
МЕТОДИКА ЕКСПЕРИМЕНТУ
Для обезводнювання слід взяти близько 30 г мідного купоросу CuSO4*5H2O, який покласти у фарфорову чашку і, попередньо зваживши порожню чашку та чашку з кристалогідратом, помістити у піч при температурі 150 – 250 0С і витримувати доти, поки увесь купорос не перетвориться в майже білий порошок. Для дослідження кінетики дегідратації зважування зразка проводити з інтервалом 10-15 хв.
Слід уникати дуже сильного нагрівання, бо при цьому сіль частково розкладається і порошок темніє від окису міді, що домішується до нього. Щоб уникнути цього, можна старанно перемішувати сіль до самого дна чашки при кожному зважуванні.
Безводну сіль можна пересипати в стаканчик і в ньому залишити, закривши склом. Безводна сірчанокисла мідь притягує до себе вологу з повітря досить повільно. Однак, якщо безводна сіль має зберігатися довший проміжок часу, то її краще пересипати гарячою в банку і закрити пробкою, яку залити парафіном. Можна також поставити стаканчик або чашку з сіллю в ексикатор.
ХІД РОБОТИ.
1. Визначити вагу фарфорового тигля.
2. Насипавши в нього (до однієї третини) подрібненого мідного купоросу, знову зважити. Записати вагу взятого мідного купоросу.
3. Поставивши тигель у піч, нагрівати мідний купорос до повного обезводнювання, зважуючи чашку з інтервалом 10-15 хв.
4. Розрахувати і записати вагу води, яка виділилася.
6. Обчислити з одержаних даних процентний вміст води в мідному купоросі, врахувавши, що вихідний кристалогідрат описується формулою CuSO4*5H2O. Нарисувати графік залежності вмісту кількості молекул води на одну молекулу Сульфату Купруму від часу нагрівання при даній температурі.
Крім мідного купоросу, можна зробити якісні спроби з залізним купоросом FeSO4*7H2O, сірчанокислим натрієм Na2SO4*10H2O та іншими наявними солями з кристалізаційною водою.
| <== предыдущая лекция | | | следующая лекция ==> |
| Исполнительные устройства | | | Предмет и история биомеханики |
Дата добавления: 2015-03-20; просмотров: 3136;
