АМПЕРОМЕТРИЧНЕ ТИТРУВАННЯ
Залежність сили дифузійного струму при відновленні або окисненні визначуваної речовини на електроді від її концентрації в розчині може бути використана для визначення кінця титрування в титриметричному аналізі. Такий метод носить назву амперометричне титрування і відноситься до непрямих полярографічних методів аналізу.
При проведенні амперометричного титрування на електроди подають постійну напругу, при якій досягається ділянка граничного дифузійнгого струму хоча б для однієї з реаґуючих речовин або продукту реакції.
Очевидно, для амперометричного титрування можуть використовуватися реакції, в результаті яких змінюється концентрація електродноактивних, тобто, здатних відновлюватися або окиснюватися на індикаторному електроді, речовин. Це реакції осадження, комплексоутворення або окиснення-відновлення.
Аналітичним сигналом в амперометричному титруванні є об’єм титранту в точці еквівалентності, яку знаходять за різким зломом на кривій залежності сили струму від об’єму прилитого титранту. Вид цієї графічної залежності зумовлений здатністю до електродної реакції як визначуваної речовини, так і титранта або продуктів реакції.
Якщо при поданій на електролітичну комірку напрузі електродноактивними є визначувана речовина і титрант, то гранична сила струму до точки еквівалентності буде зменшуватися, а за точкою — зростатиме (рис. 5а) Така форма залежності має місце, наприклад, при титруванні йонів плюмбуму біхроматом калію:
2 Pb2+ + Cr2O72– + H2O ® 2 PbCrO4 + 2 H+ (21)
У тому випадку, коли електродноактивною при заданій напрузі є тільки визначувана речовина, а електроднонеактивною — титрант, сила струму буде падати до точки еквівалентності, а за точкою — залишатиметься малою і постійною (рис. 5б), як, наприклад, при титруванні йонів нікелю диметилгліоксимом (ДМГО):
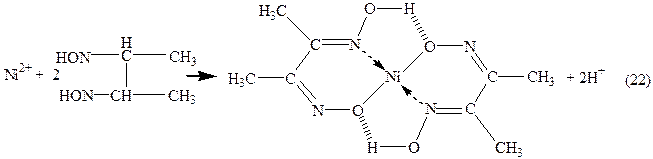
У протилежному випадку, тобто коли електродноактивним буде титрант, а електроднонеактивною — визначувана речовина, сила струму до точки еквівалентності буде залишатися малою та постійною і зростатиме за точкою еквівалентності (рис. 5в), як це має місце при титруванні йонів барію біхроматомкалію:
2 Ba2+ + Cr2O72– + H2O ® 2 BaCrO4 + 2 H+ (23)
На рис. 5г наведено залежність, що одержується при амперометричному титруванні арсенатної кислоти йодидом калію:
HAsO42– + 2 J– + 2 H+ ® HAsO32– + J2 + H2O (24)
Коли по мірі відтитровування концентрація вільного йоду, що виділяється як продукт реакції, буде зростати до точки еквівалентності, а за точкою — залишатиметься постійною. Аналогічним чином буде змінюватися сила струму, зумовленого відновленням йоду на катоді.
Часто застосовують так зване індикаторне амперометричне титрування, яке полягає в тому, що точку еквівалентності при титруванні електроднонеактивного йона електроднонеактивним титрантом визначають за зменшенням сили струму, зумовленого відновленням на електроді індикаторного йона, як, наприклад, при титруванні йонів Al3+ розчином фториду в присутності Fe3+. Йон алюмінію утворює з фторидом міцніший комплекс [AlF4]– (pKст = 7.10), ніж комплекс [FeF4]– (рКст = 6.10), тому спочатку відтитровуються йони алюмінію і лише коли весь Al3+ відтитрується, починають відтитровуватися йони заліза. Внаслідок цього на кривій залежності сили струму від об’єму титранту спостерігаються два злами (рис. 5д), що відповідають точкам еквівалентності для Al3+ та Fe3+.
Точку еквівалентності в кожному випадку знаходять графічно за перетином двох прямих, що відповідають двом ділянкам титрування — до точки еквівалентності та після точки еквівалентності. Слід зауважити, що лінійність між силою струму та об’ємом титранта зберігається лише тоді, коли можна знехтувати розведенням розчину в електролізері, наприклад, у випадку, коли концентрація титранту на порядок більша від концентрації визначуваного компонента, або коли титруючий реаґент ґенерується електрохімічно. У випадку порушення лінійності для побудови графіка титрування слід розрахувати поправки на розведення за формулою:
Івипр. = Івим.∙(Vп + Vт)/Vп (25),
де Івим. та Івипр. — сила струму виміряна та сила струму виправлена;
Vп та Vт — початковий об’єм розчину та об’єм доданого титранту, мл.
Методом амперометричного титрування можна визначати практично всі елементи періодичної системи та велику кількість органічних сполук. Метод простий і не вимагає складної апаратури.
Основною позитивною якістю методу є висока вибірковість: підбором потенціалу досягають умов, при яких в електрохімічній реакції бере участь лише одна речовина з багатокомпонентної суміші — учасник хімічної реакції. Амперометрично можна титрувати каламутні та забарвлені розчини.
Метод дозволяє проводити визначення малих кількостей речовин в досить розведених розчинах, бо амперометрична індикація кінця титрування є найчутливішою. Нижня межа визначуваних концентрацій досягає 1∙10–6 М.
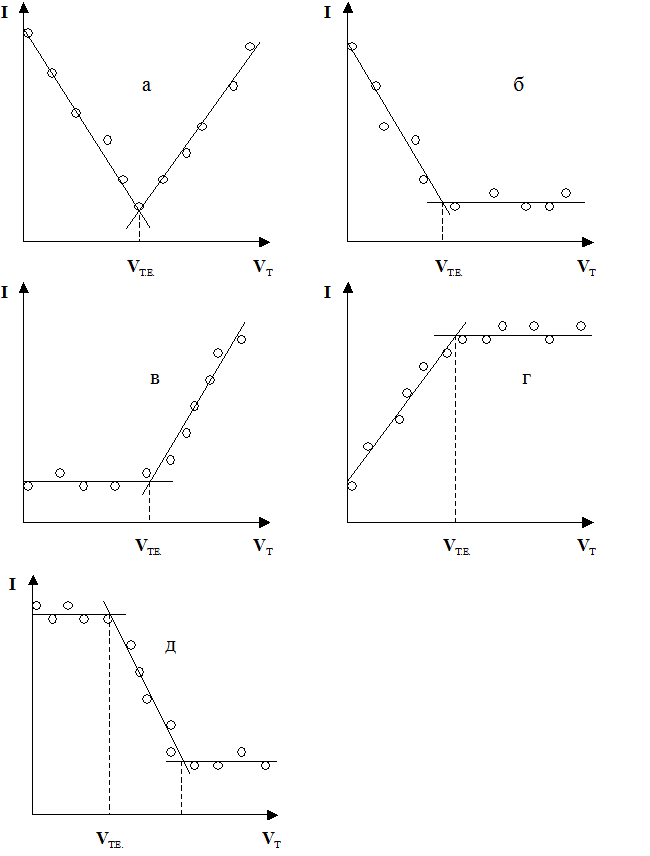
Рис. 5. Форми кривих амперметричного титрування
(пояснення див. на стор. 20, 21)
Дата добавления: 2015-02-28; просмотров: 2704;
