ІНДИКАТОРИ В АМПЕРОМЕТРИЧНОМУ ТИТРУВАННІ
В амперометричному титруванні – методі аналізу, в якому аналітичним сигналом може буте зміна граничного дифузійного струму, так само як і в звичайній візуальній титриметрії, іноді застосовують індикатори, що називаються, в силу своїх деяких особливостей, амперометричними індикаторами. Це частіше електрохімічно активні речовини, що теж реагують з титрантом. Амперометричні індикатори застосовуються, якщо визначуваний іон і титрант не дають електрохімічних реакцій. Тоді до розчину, який аналізують додають індикатор, що дає електродну реакцію і взаємодіє з розчином, що титрує, і при цьому утворює менш міцний продукт реакції, ніж визначуваний іон. У загальному вигляді для такого варіанта можна записати:
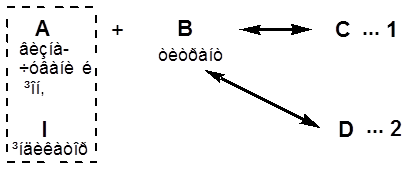 |
А, В і С електрохімічно неактивні; I – може окиснюватися або відновлюватися на мікроелектроді при накладеній на електроди напрузі . Тому що С більш міцний продукт ніж Д, то першою в розчині проходить реакція 1, а потім 2.
При зануренні електродів у розчин, на які накладена напруга відповідна середині площадки граничного струму окиснювання або відновлення індикатора, у ланцюзі спочатку фіксується високий струм (рис. 4.10, кр.1). При додаванні титранту першою проходить реакція з визначуваною речовиною. Концентрація індикатору не змінюється, струм теж залишається постійним, доки не почнеться друга реакція. Коли в розчині не залишиться речовини А, концентрація індикатора стане змінюватися (перебігає реакція 2), величина дифузійного струму теж зменшується. Таким чином, перегин на кривій титрування відповідає точці еквівалентності визначуваної речовини.
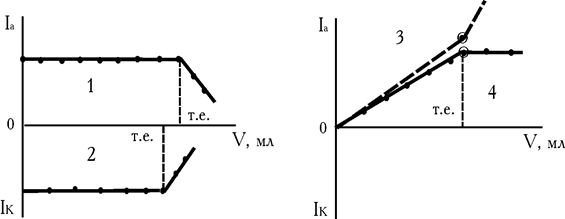
Рис. 4.10. Форми кривих титрування з амперометричними індикаторами. Загальний вид (1). Кальцію –ЕДТА в присутності Zn2+ (2). Заліза 8-меркаптохіноліном без індикатора (3). Заліза (III) 8-меркаптохіноліном у присутності CuCl2
Визначення кальцію, наприклад, етилендиамінтетраоцтовою кислотою за струмом відновлення метало-іона практично не можливе через велике негативне значення потенціалу відновлення системи Са2+/Са(Hg)–1,95 В (заважає відновлення водню). Як індикатор використовують солі цинку 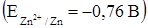 . Для того щоб Zn2+ реагував з ЕДТА після Са2+, його попередньо зв'язують в аміачний комплекс. Хімічні реакції, які перебігають у розчині:
. Для того щоб Zn2+ реагував з ЕДТА після Са2+, його попередньо зв'язують в аміачний комплекс. Хімічні реакції, які перебігають у розчині:
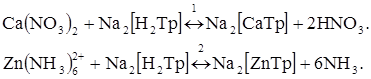
Електрохімічна реакція на мікрокатоді:
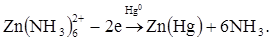
Форма кривої титрування наведена на рис. 4.10, кр.2.
У ряді випадків на практиці можна зштовхнутися і з такими труднощами при проведенні аналізу: Fe3+, IrIV і деякі інші метали відновлюються сірковмісними реагентами діетилдитіокарбамінатом, 8-меркаптохінолінатом до Fe2+, IrIII, які окиснюються на мікроаноді (протягом титрування струм збільшується). Надлишок титранту теж окиснюється на мікроаноді (підйом iгран. продовжується). Точку еквівалентності визначити важко, якщо нахили прямих мало відрізняються один від одного (рис. 4.10, кр.3).
Для таких випадків вводять амперометричний індикатор, речовину, яка може зв'язати надлишок розчину, що титрує, і утворити з ним малорозчинну речовину. Як у першому, так і в другому прикладі важливо, щоб амперометричний індикатор реагував з титрантом тільки після визначуваної речовини.
При визначенні заліза та іридію 8-меркаптохіноліном в якості індикатора додають невелику кількість сульфату міді, хімічні реакції в розчині:
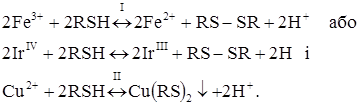
Відповідно електродні процеси:
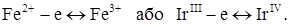
Форма кривої надана на рис. 4.10, кр.4.
Амперометричні індикатори використовують і при аналізі складних багатокомпонентних зразків. Розчин, що титрує, може послідовно осаджувати два або більш метало-іонів. Хоча реакції в розчині перебігають послідовно (сполуки мають різні добутки розчинності), але точки еквівалентності не видно. Відтитровується сума цих речовин. Тоді як індикатори застосовують солі металів, криві титрування яких мають аномальну форму.
Використовуючи такі індикатори можливо визначити мідь (II) у присутності кадмію (II) діетилдитіокарбамінатом, додавши як індикатор нітрат свинцю. За міцностю ці тіокарбамінати можна розташувати в такий ряд:
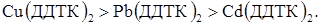
Таким чином з титрантом спочатку взаємодіє мідь (II), потім реагує свинець (II), що утворює проміжний електроактивний продукт [PbOHДДТК]m–, поява якого супроводжується ростом струму в ланцюзі. Точка еквівалентності для Cu2+ стає «видимою» (рис. 4.11, кр.2). Аналогічні ефекти спостерігаються і при титруванні паладію в присутності цинку, кадмію та інших катіонів. За міцнстю ці тіооксинати розташовані в наступний ряд:
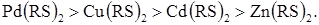
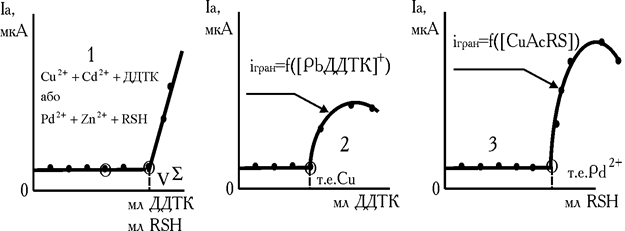
Рис. 4.11. Форми кривих амперометричного титрування Cu2+ і Cd2+ (Pd2+ і Zn2+) діетилдитіокарбамінатом або 8-меркаптохіноліном відповідно (1), суміші Cu2+, Cd2+ і Pb2+ (2), Pd2+, Zn2+ і Cu2+ (3). Амперометричні індикатори Pb(NO3)2 (2) і CuSO4 (3)
У зв'язку з чим з 8-меркаптохіноліном спочатку реагує паладій, потім мідь, утворюється проміжний електрохімічно активний комплекс [CuAcnRS]m–, окиснювання останнього на електроді сприяє фіксації точки еквівалентності для паладію (рис. 4.11, кр.3).
Дата добавления: 2015-03-19; просмотров: 1081;
