Биологическая роль комплексных соединений
Комплексные соединения, рассмотренные нами выше, содержали лиганды, в основном, неорганической природы. Однако, в биологи-ческих системах огромную роль играют комплексные соединения, в которых в качестве лигандов выступают сложные органические молекулы, обладающие полидентатными свойствами (т. е., способны образовывать с комплексообразователем несколько связей).
Металлопротеины
К металлопротеинам относят биополимеры, которые, помимо белка, содержат простетическую группу (компонент небелкового характера), включающую ионы металлов.
Отдельную группу металлопротеинов составляют гемопро-теины, содержащие в качестве простетической группы соединения железа. Одним из важнейших гемопротеинов является гемоглобин. Он состоит из белка (глобина) и комплекса железа с порфирином (гема). В геме ион Fe2+ (комплексообразователь), связан с двумя атомами азота, принадлежащими порфириновому кольцу, ковалентной связью, а еще с двумя - координационной. Координа-ционное число Fe2+ равно шести: в порфириновом комплексе пятое координационное место занимает гистидиновая группа белка, образуя координационую связь атома азота с Fe2+. В отсутствие кислорода шестым лигандом является вода. В случае, когда вода замещается на кислород, образуется оксигемоглобин. Кроме воды и кислорода ион Fe2+ может связывать и некоторые другие лиганды, например, СО, CN- и оксиды азота. Так, с молекулами угарного газа гемоглобин образует карбоксигемоглобин, а с оксидами азота - метгемоглобин, содержащий ионы Fe3+. Накопление этих видов гемоглобина в крови приводит к снижению снабжения тканей кровью.
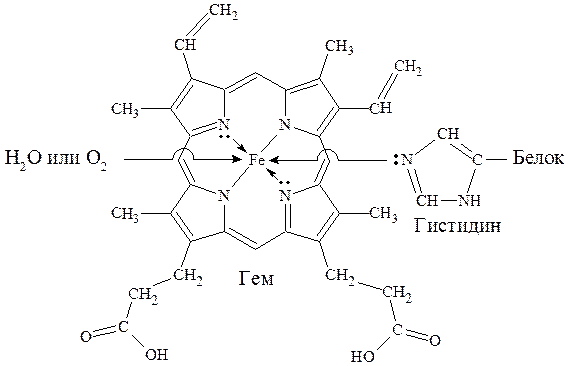
Схема образования связей в гемоглобине
Гем в виде гем-порфирина является простетической группой производных гемоглобина: миоглобина, каталазы, пероксидазыи цитохромов.
Отличительной особенностью гемоглобина (миоглобина) являет-ся постоянство степени окисления железа Fe2+. Равновесие:
О2 + гемоглобин ⇄ оксигемоглобин
в легких смещено вправо, а в клетках – влево.
Таким образом, гемоглобин (миоглобин) является переносчиком молекул (Н2О, О2).
Транспортные функции выполняют и цитохромы,в которых связь между гемом и полипептидной цепью осуществляется при помощи остатков цистеина белковой цепи.
Однако, в отличие от гемоглобина и миоглобина, механизм их действия основан на изменении степени окисления железа:
Fe2+ - 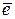
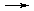 Fe3+,
Fe3+,
Fe3+ + 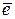
 Fe2+.
Fe2+.
Передавая электроны от цитохрома b к цитохромооксидазе, ионы железа участвуют в процессе окислительного фосфорилирования.
С кислородом и СО цитохромы не взаимодействуют.
Витамины
Единственным витамином, содержащим в своей структуре металл, является витамин В12 (кобаламин).
В его состав входит ион Со3+, который находится в центре плос-кой корриновой системы (подобна порфириновой) и связан с атомами азота восстановленных пиррольных колец. Перпендикулярно плос-кости корриновой системы расположен нуклеотидный лиганд, состо-ящий из 5,6-диметилбензимидазола и рибозы с остатком фосфорной кислоты. Наконец, шестым лигандом является цианид-ион.
Витамин В12 содержится в ферментных системах в виде В12-ко-ферментов или кобамидных коферментов - метилкобаламина, содер-жащего дополнительную метильную группу, и дезоксиаденозин-кобаламина, содержащего 5¢-дезоксиаденозинкобаламин.
Так, метил-кобаламин выполняет функции переносчика метильной группы в реакции синтеза метионина. Кроме того, витамин В12 необходим для образования эритроцитов.
Недостаток витамина12 приводит к нарушениям деятельности нервной системы и вызывает резкое снижение кислотности желудоч-ного сока.
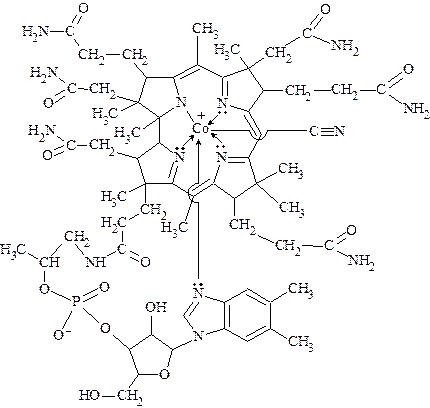
Схема образования связей в витамине B12 (кобаламине)
Ферменты
Ферментами называют класс веществ белковой природы, катали-зирующих большое число химических реакций. Ферменты обеспечи-вают реализацию генетической информации, а также обмен веществ и энергии. Ферменты отличаются от неорганических катализаторов значительно большей активностью и высокой специфичностью действия: один фермент, как правило, катализирует только одну химическую реакцию.
Действующим началом фермента карбоксипептидазы, катализи-рующего процессы гидролиза, является ион Zn2+. Ион цинка оттягивает на себя электроны карбонильной группы С = O в пептиде (- СО - NH -), в результате связь С = O еще больше поляризуется, что облегчает гидролиз и разрыв С-N связи.
Ионы цинка также входят в состав фермента карбоангидразы, который катализирует гидратацию СО2, т. е. образование иона НСО3-, и в тоже время участвует в каталитическом разложении НСО3-, которое сопровождается выделением СО2. Первая реакция протекает в альвеолах легких, вторая (обратная) - в клетках.
Некоторые другие комплексные соединения металлов, играющие определенную биологическую роль, приведены в таблице 2.
Таблица 2. Биологически важные комплексы металлов.
| Металл | Тип биомолекулы | Лиганды | Биологическая функция |
| Cu2+ | Цитохромооксидаза, церулоплазмин и др. | Азотистые основания | Окисление, депонирование и транспорт меди |
| Mn2+ | Аргиназа, декарбокси-лазы аминокислот, фосфотрансферазы и др. | Фосфат, имидазол | Декарбоксили-рование, перенос фосфатных групп |
| Mo2+ | Нитрогеназа, нитрат-редуктаза, ксантин-оксидаза | Не иденти-фицированы | Восстановление N2 в NH3, окисление пуринов |
| Mg2+ | Хлорофилл | Порфирин | Превращение световой энергии в энергию химичес-ких связей |
| Cr3+ | Дрожжи | Никотиновая кислота, амино-кислоты | Участие в угле-водном обмене, усиление действия инсулина |
Дата добавления: 2016-12-08; просмотров: 1738;
