Хелаты и внутрикомплексные соединения
Циклические комплексные соединения, в образовании которых принимают участие полидентатные лиганды, называются хелатами. Полидентатные лиганды обычно представляют собой многоатомные спирты, амины и их производные. Электронодонорные атомы лиганда (N, O, S и др.) расположенные на некотором расстоянии друг от друга, за счет донорно-акцепторных связей образуют с комплексообразователем циклы (один или несколько). Обычно встречаются пяти- и шестичленные циклы, реже - четырехчленные.
Например, 1,2-диаминоэтан, в котором два донорных атома разделены двумя СН2-группами
H2N – CH2 – CH2 – NH2,
с ионами кобальта Со3+ образует хелатный комплекс:
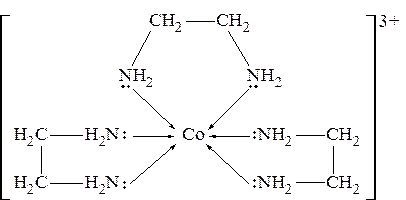
Хелатные комплексы отличаются повышенной прочностью. Это относится как к термической прочности, так и к устойчивости внутренней сферы в водных растворах. О последнем свидетельствует сравнение величин констант нестойкости хелатного комплекса кобальта с 1,2-диаминоэтаном и иона гексамминкобальта (III), кото-рые, соответственно, равны 2×10-49 и 7×10-36. В обоих случаях имеется связь кобальта с азотом. Разница заключается лишь в том, что в первом случае образуется циклическая структура, а во втором - нет.
Если помимо координационной связи, полидентатный лиганд связан с комплексообразователем еще и ковалентной связью, то образуется дополнительный хелатный цикл. Такие соединения называются внутрикомплексными. Соединения, которые образуют внутрикомплексные соединения с ионами металлов, называются комплексоны. Такими свойствами, например, обладают органи-ческие производные аминополикарбоновых кислот:
| Комплексон I | 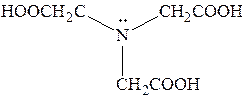 три(карбоксиметил)амин
или нитрилоуксусная кислота
три(карбоксиметил)амин
или нитрилоуксусная кислота
|
| Комплексон II | 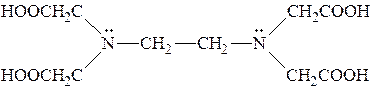 1,2-бис[ди(карбоксиметил)амин]
или этилендиаминтетрауксусная кислота (ЭДТА)
1,2-бис[ди(карбоксиметил)амин]
или этилендиаминтетрауксусная кислота (ЭДТА)
|
| Комплексон III | 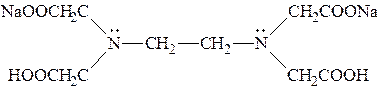 динатриевая соль ЭДТА или трилон Б
динатриевая соль ЭДТА или трилон Б
|
На практике чаще используется трилон Б, так как эта динатриевая соль лучше растворима в воде по сравнению с ЭДТА. Трилон Б образует прочные растворимые в воде комплексы с катионами металлов, так как кроме двух ковалентных связей (при замещении ионов водорода в -СООН группах) образуются две дополнительные координационные связи с участием неподеленных пар электронов атомов азота:
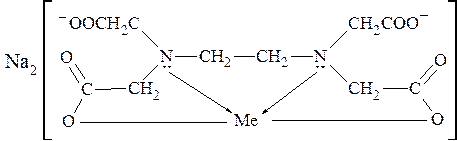
где Me - Mg2+, Ca2+, Sr2+, Ba2+, Mn2+ Fe2+, Cu2+, Zn2+, Pb2+ и др.
В случае трехвалентных комплексообразователей (Al3+, Ga3+, Ce3+ и др.) комплексы имеют более сложное октаэдрическое строение.
Внутрикомплексные соединения четырехвалентных металлов отличаются тем, что не имеют внешней сферы, т.е. не являются электролитами.
К внутрикомплексным соединениям относятся многие биоло-гические комплексы, например, хлорофилл (комплексообразователь - Mg2+), гемоглобин (Fe2+), витамин В12 (Co3+) и многие другие.
Комплексоны используют в медицинской практике. Например, при отравлениях тяжелыми металлами (Pb2+, Hg2+) для их связывания и выведения из организма применяют ЭДТА. Трилон Б применяется при заболеваниях, связанных с избыточным отложением солей кальция в организме (артриты, артрозы, отложение кальция в почках, венах, мышцах). Трилон Б также используют как антикоагулянт при консервировании крови.
Комплексонометрия
Метод объемного анализа, в котором в качестве рабочих раст-воров (титрантов) используют растворы комплексонов, называется комплексонометрией. Метод применяют для определения концентрации ионов металлов в растворах, в том числе в биологических жидкостях, сточных водах и т. д.
В частности, комплексонометрию используют для определения общей жесткости воды. Жесткость воды, как известно, обусловлена присутствием солей кальция и магния - гидрокарбонатов, хлоридов, сульфатов, и др. Различают временную жесткость, вызванную нали-чием гидрокарбонатов, и постоянную, причиной возникновения которой является, в основном, присутствие хлоридов и сульфатов. Общая жесткость воды складывается из временной и постоянной жесткости и выражается суммарной молярной концентрацией эквивалента катионов Ca2+ и Mg2+ (ммоль/л). Использование жесткой воды приводит к образованию накипи в котлах и отопительных приборах, повышает расход моющих средств. Верхний предел жесткости воды в системах водоснабжения составляет, как правило, 7 ммоль/л.
Точку эквивалентности в методекомплексонометрии фиксируют при помощи металлоиндикаторов (эриохром черный Т, мурексид и др.). Металлоиндикаторы представляют собой однозамещенные соли слабых многоосновных органических кислот.
Так, эриохром черный Т имеет структуру:
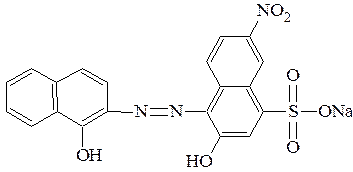
которую можно кратко представить как NaH2Ind.
Кислотность этого соединения обусловлена наличием фенольных групп, величины 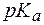 которых равны 7,7 и 9,5. В водных растворах этот индикатор может находится в виде трех форм, соотношение которых зависит от pH среды. Это находит отражение в изменении окраски раствора:
которых равны 7,7 и 9,5. В водных растворах этот индикатор может находится в виде трех форм, соотношение которых зависит от pH среды. Это находит отражение в изменении окраски раствора:
Н2Ind- ⇄ Н 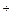 + HInd2- ⇄ 2Н
+ HInd2- ⇄ 2Н 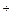 + Ind3-.
+ Ind3-.
красный синий желтый
(рН < 7) (pH = 7÷11) (pH > 11)
Отличительной особенностью этих соединений является способ-ность образовывать с ионами металлов окрашенные, малопрочные и растворимые в воде комплексы. Так, при добавлении эриохрома черного Т к водопроводной воде при рН = 7÷11 образуется красный комплекс индикатора с ионами Са2+ и Mg2+:
HInd2-(cиний) + Ca2+ ⇄ [CaInd]-(красный) + H+
HInd2-(cиний) + Mg2+ ⇄ [MgInd]-(красный) + H+
Образующиеся при этом ионы H+ нейтрализуются аммиачным буфером и в системе поддерживается постоянство pH на уровне 7÷11.
Полученные при этом комплексы характеризуются меньшей прочностью по сравнению с внутрикомплексными соединениями. Действительно, значения 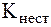 [MgInd]- и [MgTr]2- соответственно равны 2,8·105 и 5·108. Поэтому при добавлении трилона Б конкуренцию за ионы Ме2+ выигрывает комплексон, так при этом образуется более прочный комплекс:
[MgInd]- и [MgTr]2- соответственно равны 2,8·105 и 5·108. Поэтому при добавлении трилона Б конкуренцию за ионы Ме2+ выигрывает комплексон, так при этом образуется более прочный комплекс:
Ме2+ + H2Tr2- 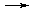 MeTr2- + 2H+
MeTr2- + 2H+
В точке эквивалентности ярко окрашенный комплекс металла с индикатором полностью разрушается и индикатор выделяется в индивидуальной форме:
МеInd- + H2Tr2- 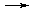 MeTr2- + HInd2- + H+,
MeTr2- + HInd2- + H+,
цвет которой определяется рН раствора.
Таким образом, если применять индикатор эриохром черный Т, то точку эквивалентности можно зафиксировать по переходу окраски раствора из красной в синюю.
Дата добавления: 2016-12-08; просмотров: 2358;
