Ионные равновесия в растворах комплексных соединений
В водных растворах комплексные соединения диссоциируют ступенчато. Различают первичную и вторичную диссоциацию.
Первичная диссоциация - это диссоциация комплексного соединения на комплексный ион и внешнюю сферу:
K4[Fe(CN)6]  4K+ + [Fe(CN)6]4-.
4K+ + [Fe(CN)6]4-.
Первичная диссоциация протекает полностью, это диссоциация сильного электролита.
Вторичная диссоциация протекает в очень малой степени из-за высокой прочности комплексного иона:
[Fe(CN)6]4- ⇄ Fe2+ + 6CN-
Константа химического равновесия для реакции вторичной дис-социации называется константой нестойкостикомплексного иона:

| (1) |
Величина, обратная константе нестойкости, называется константой устойчивостикомплексного иона:
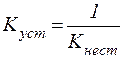
| (2) |
Величины констант нестойкости и устойчивости могут являться мерой термодинамической прочности комплексного иона. Действи-тельно, оценить возможность самопроизвольного протекания процес-са диссоциации комплексного иона можно по величине изменения энергии Гиббса, которая связана с 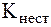 и
и 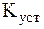 соотношением:
соотношением:
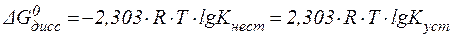
| (3) |
Видно, что чем меньше величина 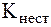 и чем больше величина
и чем больше величина 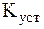 , тем более положительной является изменение энергии Гиббса, и, соответственно, меньшей степень диссоциации комплекса.
, тем более положительной является изменение энергии Гиббса, и, соответственно, меньшей степень диссоциации комплекса.
Таким образом:
Комплексный ион тем прочнее, чем меньше величина константы нестойкости и чем больше величина константы устойчивости.
Обе константы являются индивидуальными характеристиками комплексных ионов и приведены в справочниках.
Дата добавления: 2016-12-08; просмотров: 972;
