Природа химической связи в комплексных соединениях
Многообразие комплексных соединений ставит перед исследо-вателями вопросы о специфике взаимодействий между комплексо-образователем и лигандами, в результате которых во внутренней сфере комплекса могут быть прочно связаны различные по химичес-кой природе ионы или молекулы. Было предложено множество теорий, большинство из которых в настоящее время представляет интерес только для истории. На наш взгляд, естественным было создание и развитие теории строения комплексных соединений на основе теории образования химической связи.
Рассмотрим образование комплексных соединений с точки зрения теории валентных связей.
Теория валентных связей основывается на представлении о двухэлектронной химической связи. Такая связь может быть образо-вана путем объединения неспаренных электронов, находящихся на орбиталях разных атомов. В таком случае она называется ковалентной. Иной механизм образования двухэлектронной связи реализуется в случае, когда один атом предоставляет пустую орбиталь (акцептор), а другой - неподеленную электронную пару (донор). В данном случае говорят об образовании ковалентной связи по донорно-акцепторному механизму. Такую связь еще называют координационной.
В большинстве случаев связь между комплексообразователем и лигандами осуществляется по донорно-акцепторному механизму. Так, в образовании комплексного иона [Cr(NH3)6]3+ участвуют 3d, 4s и 4p орбитали иона Cr3+:
| 3d | 4s | 4p | |||||||||
| Cr3+ | 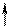
| 
| 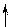
| 
| |||||||
|
|
которые взаимодействуют с неподеленными электронными парами аммиака, образуя комплексный ион [Cr(NH3)6]3+:
| 3d | 4s | 4p | |||||||||
| [Cr(NH3)6]3+ | 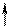
| 
| 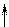
| 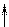 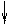
|  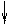
| 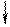 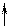
| 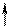 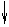
| 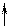 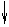
|  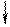
| ||
Таким образом, химические связи образуются путем передачи части электронной плотности аммиака на вакантные орбитали Cr3+. Видно, что в процессе участвуют различные подуровни комплексо-образователя. Это означает, что образованные связи с лигандами должны иметь различные характеристики, в частности, прочность. Однако экспериментальные результаты свидетельствуют об обрат-ном: прочность всех связей одинакова.
Это противоречие удалось устранить при помощи понятия о гибридизации орбиталей. Гибридизация заключается в том, что все электронные орбитали комплексообразователя, участвующие в обра-зовании связей, становятся совершенно одинаковыми, за исключе-нием их направлений. Гибридизованные орбитали вытягиваются по направлению к лигандам, что способствует большему перекрыванию с орбиталями лигандов, т.е. способствует упрочению связей.
В рассмотренном случае гибридизации подвергаются две d-орбитали, одна s-орбиталь и три p-орбитали иона Cr3+. Такой тип гибридизации называют d2sp3-гибридизация.
Тип гибридизации орбиталей комплексообразователя определяет его координационное число и общую геометрию комплексного соединения. Некоторые примеры типов гибридизации орбиталей и соответствующие им пространственные конфигурации связей приведены в табл. 1.
Таблица 1. Некоторые типы гибридизации орбиталей.
| Тип гибридизации | Координа-ционное число | Пространственная конфигурация связей | Пример |
| sp | Линейная | [Ag(CN)2]- | |
| sp2 | Треугольник | [HgI3] - | |
| sp3 | Тетраэдр | [NiCl4]2- | |
| sp2d | Квадрат | [Pt(NH3)4]+ | |
| sp3d | Тригональная бипирамида | [Fe(CO)5] | |
| sp3d2 | Октаэдр | [Co(NH3)6]3+ |
Представления о гибридизации орбиталей позволяют объяснить повышенную координацию некоторых комплексообразователей. Так, ион Co3+ имеет следующую конфигурацию внешнего электронного уровня:
| 3d | 4s | 4p | |||||||||
| Co3+ |  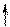
| 
| 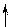
| 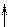
| 
| ||||||
Видно, что у иона Co3+ имеются 4 вакантные орбитали. Это означает, что максимальное число связей с лигандами у иона Co3+ не может быть больше четырех. Однако известны случаи, когда ион Co3+ координирует вокруг себя до шести лигандов.
Повышение координации иона Co3+ объясняется тем, что в результате гибридизации орбиталей происходит спаривание электро-нов d-подуровня. При этом конфигурация внешнего электронного уровня иона Co3+ принимает вид :
| 3d | 4s | 4p | |||||||||
| Co3+ | 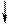 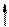
| 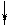 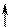
| 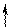 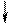
| ||||||||
Видно, что число вакантных орбиталей увеличилось от 4 до 6.
Теория валентных связей позволяет заключить:
1) Самую большую группу комплексообразователей образуют d- и f-элементы в разнообразных степенях окисления. Реже встречаются комплексные соединения, в которых комплексообразователями являются s- и p-элементы (например, щелочные и щелочно-земельные металлы) и ионы с отрицательным зарядом (например, I-).
2) Связь лигандов с комплексообразователем является ковалент-ной и осуществляется по донорно-акцепторному механизму.
3) Ионы внешней сферы образуют с комплексными ионами преимущественно ионные связи и компенсируют заряд внутренней сферы.
Дата добавления: 2016-12-08; просмотров: 1044;
