Разрушение комплексного иона
Под разрушением комплексного иона понимают его разложение в растворе на составные части. Так как процесс диссоциации комплекс-ного иона является равновесным, то к нему применимо правило сдвига химического равновесия (принцип Ле Шателье).
Так, в равновесии:
[Ag(NH3)2]+ ⇄ Ag+ + 2NH3
увеличение концентрации NH3 в растворе приводит к увеличению концентрации комплексного иона, а удаление NH3, наоборот, вызывает разложение комплекса. Таким образом, добиться разру-шения комплексного иона можно путем связывания продуктов диссоциации либо в более прочные комплексы (имеющие меньшую величину 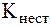 ), либо в малорастворимые соединения.
), либо в малорастворимые соединения.
Пример 1. Можно ли разрушить комплексный ион [Ag(NH3)2]+ добавлением к его раствору HNO3, если 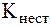 ([Ag(NH3)2]+) = 6,8×10-8,
([Ag(NH3)2]+) = 6,8×10-8, 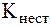 (NH4+) = 5,6×10-10?
(NH4+) = 5,6×10-10?
Решение.
При добавлении сильной кислоты HNO3 в растворе возникают конкурирующие равновесия:
Ag+ + 2NH3 ⇄ [Ag(NH3)2]+
NH3 + H+ ⇄ NH4+
В общем случае, конкуренцию выигрывает процесс, который сопровождается образованием более устойчивого соединения, т.е. большей убылью DG0. Согласно уравнению 3, комплекс NH4+ более устойчив, чем [Ag(NH3)2]+, так как 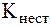 (NH4+) <
(NH4+) < 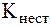 ([Ag(NH3)2]+).
([Ag(NH3)2]+).
Таким образом, добавление HNO3 приводит к разрушению комплексного иона [Ag(NH3)2]+ и образованию иона NH4+.
Пример 2. Можно ли разрушить комплексный ион [Ag(CN)2]-, если к его раствору добавить некоторое количество Na2S? 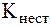 ([Ag(CN)2]-) = 1,4×10-20,
([Ag(CN)2]-) = 1,4×10-20, 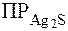 = 6,3×10-50.
= 6,3×10-50.
Решение.
В данном случае в растворе конкурируют равновесия:
Ag+ + 2CN- ⇄ [Ag(CN)2]-,
2Ag+ + S2- ⇄ Ag2S¯
Величины DG0 этих процессов зависят от значений константы нестойкости (устойчивости) комплекса и произведения раствори-мости осадка (см. уравнения (6) и (7) в главе «Гетерогенные равновесия»). Однако эти соотношения учитывают только термоди-намический фактор образования осадка или комплекса, но не всегда удовлетворяют кинетике протекающих процессов. Поэтому, в общем случае, сопоставление величин 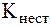 и ПР не является вполне корректным. Такое сравнение допустимо только в том случае, если эти величины отличаются на много порядков.
и ПР не является вполне корректным. Такое сравнение допустимо только в том случае, если эти величины отличаются на много порядков.
В данном случае величина ПР сульфида серебра на тридцать порядков меньше константы нестойкости ([Ag(CN)2]-), поэтому можно с уверенностью утверждать, что добавление Na2S приведет к разрушению комплекса и образованию осадка Ag2S.
Дата добавления: 2016-12-08; просмотров: 1072;
