Изомерия комплексных соединений
Изомерией называют такое явление, когда вещества, имеющие одинаковый состав и молекулярную массу, обладают различным строением и, следовательно, различными свойствами. Изомерия широко распространена среди комплексных соединений и является одной из причин их многообразия. Различают геометрическую, оптическую, гидратную, ионизационную и другие виды изомерии.
1. Геометрическая изомерия.
Этот вид изомерии обусловлен различным расположением лигандов относительно друг друга и распространен у комплексных соединений, имеющих геометрию плоского квадрата, октаэдра или квадратной пирамиды. Линейные и тетраэдрические комплексы геометрических изомеров не имеют.
Смешанные комплексы состава [MeA2B2], имеющие конфигу-рацию плоского квадрата, могут иметь два изомера. Если одинаковые лиганды находятся по одну сторону от комплексообразователя, то образуется цис-изомер(от лат. cis - по эту сторону), а если по разные стороны, - образуется транс-изомер(от лат. trans - по ту сторону).
Геометрические изомеры могут проявлять различные свойства. Так, цис-изомер [Pt(NH3)2Cl2] оказывает лечебное действие при раковых заболеваниях, тогда как транс-изомер противоопухолевым действием не обладает:
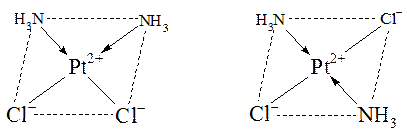
цис-изомер транс-изомер
Октаэдрические комплексы состава [MeA4B2] и [MeA3B3] также имеют по два геометрических изомера. С увеличением числа различных лигандов возрастает и число геометрических изомеров. Так, у октаэдрического комплекса с шестью различными лигандами существует 15 геометрических изомеров.
2. Оптическая изомерия.
Оптическая изомерия возникает у комплексных соединений, структуры внутренних сфер которых не совмещаются в трехмерном пространстве и являются как бы зеркальным отображением друг друга. Оптическая изомерия комплексных соединений возможна только тогда, когда внутренняя сфера не имеет ни одной плоскости симметрии, т.е. плоскости, которая разделила бы ее на две одинаковые части.
Комплексные соединения с координационным числом 4 могут иметь оптические изомеры только в том случае, если они построены тетраэдрически, и во внутренней сфере нет одинаковых лигандов:
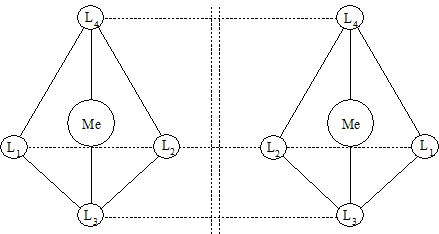
К таким соединениям относятся, например, ионы тетраалкил-аммония [NR1R2R3R4]+, где R1, R2, R3, R4 - различные органические радикалы.
Важнейшим физическим свойством оптических изомеров является способность вращать плоскость поляризации света.
В целом, на макроуровне, по своим физическим и химическим свойствам оптические изомеры практически не отличаются друг от друга, но их физиологическое воздействие в ряде случаев может быть различным.
3. Сольватная изомерия.
Причиной возникновения сольватной изомерии является неодинаковое распределение молекул растворителя между внутренней и внешней сферами.
Например, для хлорида гексааквахрома (III) известны 3 изомера:
[Cr(H2O)6]Cl3 (кристаллы серо-сиреневого цвета);
[Cr(H2O)5Cl]Cl2×H2O (кристаллы светло-зеленого цвета);
[Cr(H2O)4Cl2]Cl×2H2O (кристаллы изумрудно-зеленого цвета).
Доказательством существования этих форм является то, что раствор нитрата серебра в первом случае осаждает все ионы хлора, во втором - ⅔, а в третьем - ⅓ часть хлора.
При высушивании гидраты теряют только ту воду, которая находится во внешней сфере.
4. Ионизационная изомерия.
Этот вид изомерии связан с различным распределением ионов различного типа между внутренней и внешней сферами комплекса. Ионизационные изомеры могут быть, например, у соединения состава CoBrSO4∙(NH3)5: [Co(NH3)5Br]SO4 и [Co(NH3)5SO4]Br. Кристаллы ионизационных изомеров имеют различную окраску, а их растворы могут отличаются и по химическим свойствам: в первом случае из раствора не удается осадить ионы брома нитратом серебра, а во втором - осадить сульфат-ионы хлоридом бария.
5. Координационная изомерия.
Координационная изомерия может наблюдаться у комплексных соединений, состоящих из двух внутренних сфер и заключается в различном распределении лигандов между сферами. Например: [Pt(NH3)4][PdCl4] и [Pd(NH3)4][PtCl4].
Дата добавления: 2016-12-08; просмотров: 1160;
