Химические свойства металлов
Валентные электроны металлов слабо связаны с ядром, поэтому металлы являются типичными восстановителями (легко отдают электроны, превращаясь в положительно заряженные ионы). По активности металлы располагаются в ряд, называемый электрохимическимрядом напряжений или рядом активностей металлов. Металлы, стоящие в ряду активностей до водорода, имеют отрицательные значения стандартных электродных потенциалов (j0), а металлы, стоящие после водорода - положительные значения j0. Чем левее стоит металл, тем больше его активность.
Металлы реагируют с кислородом воздуха с образованием оксидов, а щелочные и щелочноземельные металлы - пероксидов и супероксидов: 4Li + O2  2Li2O (оксид лития)
2Li2O (оксид лития)
2Na + O2  Na2O2 (пероксид натрия)
Na2O2 (пероксид натрия)
К + О2  КО2 (супероксид калия)
КО2 (супероксид калия)
Металлы реагируют с неметаллами: 2Al +3S 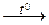 Al2S3 .
Al2S3 .
Активные металлы способны вытеснять водород из воды:
2Na + 2H2O  2NaOH + H2
2NaOH + H2
Более активные металлы вытесняют менее активные из оксидов и солей: Cr2O3 + 2Al  Al2O3 + 2Cr
Al2O3 + 2Cr
CuSO4 + Fe  FeSO4 + Cu
FeSO4 + Cu
Реакции металлов с кислотами:
1. Кислоты-неокислители (все кислоты, кроме H2SO4 конц. и HNO3 любой концентрации) реагируют только с металлами, стоящими в ряду напряжений до водорода. В результате реакции образуется соль и выделяется водород: 2Al+6HCl  2AlCl3+3H2
2AlCl3+3H2 
2. Кислоты-окислители (H2SO4 конц., HNO3 конц., HNO3 разб.) реагируют со всеми металлами, кроме Au и Pt. В результате образуются соль, вода и продукт восстановления кислоты, который зависит от концентрации кислоты и активности металла:
Например, Cu + 2H2SO4 конц.  CuSO4 + 2H2O + SO2
CuSO4 + 2H2O + SO2 
Cu + 4HNO3 конц.  Cu(NO3)2 + 2H2O + 2NO2
Cu(NO3)2 + 2H2O + 2NO2 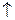
3Cu + 8HNO3 разб.  3Cu(NO3)2 + 4H2O + 2NO
3Cu(NO3)2 + 4H2O + 2NO 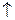
Металлы, стоящие в ряду напряжений до алюминия, восстанавливают очень разбавленную азотную кислоту до NH4NO3: Сa+10HNO3оч.разб.  4Ca(NO3)2 +3H2O+NH4NO3
4Ca(NO3)2 +3H2O+NH4NO3
Коэффициенты в вышеуказанных реакциях расставляются по правилам окислительно-восстановительных реакций.
Концентрированные серная и азотная кислоты пассивируют такие металлы, как железо, алюминий, хром и некоторые другие, покрывая их прочной оксидной пленкой, которая препятствует дальнейшему окислению.
Дата добавления: 2016-11-22; просмотров: 768;
