Электродные потенциалы
Если металл погрузить в раствор собственной соли, то возможны два процесса:
1) достройка кристаллической решетки металла за счет осаждения ионов из раствора (поверхность металла заряжается положительно);
2) переход ионов металла в раствор за счет взаимодействия с молекулами воды (поверхность металла заряжается отрицательно).
Заряженная поверхность притягивает ионы противоположного знака из раствора. В результате между металлам и раствором возникает разность потенциалов, а на границе – двойной электрический слой.
M  Mn+ + ne-
Mn+ + ne-
Равновесие имеет динамический характер, процессы идут с одинаковой скоростью в прямом и обратном направлениях. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. Абсолютные значения электродных потенциалов экспериментально определить невозможно, однако можно определить разность потенциалов. Поэтому для характеристики электродных процессов пользуются относительными значениями электродных потенциалов. За нулевой потенциал принимают потенциал стандартного водородного электрода.
Стандартный водородный электрод состоит из платиновой пластинки, погруженной в раствор серной кислоты с концентрацией ионов водорода, равной 1 моль/л. через этот раствор при давлении 101325 Па и температуре 298 К пропускают газообразный водород, который адсорбируется платиной и взаимодействует с раствором:
2H+ + 2e-  H2; j° (2H+/H2) = 0 В
H2; j° (2H+/H2) = 0 В
для определения потенциала металлического электрода собирают гальванический элемент, который состоит из стандартного водородного и металлического электродов:
H2, Pt ½ H2SO4 ½½ Mn+ ½M
Если концентрация ионов металла в растворе электролита равна 1 моль/л, то потенциал такого электрода называется стандартным электродным потенциалом, j° (Мn+/M). Они количественно характеризуют восстановительную способность атомов металлов и окислительную способность ионов металлов. Чем более отрицательное значение имеет стандартный электродный потенциал металла, тем более сильным восстановителем является металл. Наоборот, чем более положительное значение потенциала, тем большими окислительными способностями обладает ион металла.
Если концентрация иона металла в электролите не равна 1 моль/л, то потенциал такого электрода рассчитывается по уравнению Нернста:
j(Мn+/M) =j°(Мn+/M) + 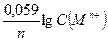
если соединить два металлических электрода, то получим систему, называемую гальваническим элементом. При его работе электроны будут перетекать от более отрицательного к более положительному электроду, возникает электрический ток. При этом более отрицательный электрод (анод) будет растворятся, а ионы электролита более положительного электрода (катода) – осаждаться из раствора на поверхность металла.
Zn½1M ZnSO4 ½½ 1M CuSO4 ½Cu
j° (Zn2+/Zn) = -0,76 В (Zn – анод)
j° (Сu2+/Cu) = +0,34 В (Cu – катод)
Электродные процессы: Zn – 2e- ® Zn2+
Cu2++ 2e- ® Cu

Zn + Cu2+ ® Zn2+ + Cu
Электродвижущая сила гальванического элемента, ЭДС (Е) – это работа, которую может совершить гальванический элемент. Она определяется как разность потенциалов:
Е = j(катода) – j(анода)
КОРРОЗИЯ МЕТАЛЛОВ
Процесс разрушения веществ под действием окружающей среды называется коррозией. При этом металл окисляется, образуя продукты коррозии, состав которых зависит от условий протекания процесса.
Коррозия – самопроизвольный процесс, ей подвергаются практически все металлы, кроме золота и платины. Это – экзотермический процесс, энергия выделяется в виде тепла.
Ежегодно 10% производимого в мире металла безвозвратно теряется в результате коррозии.
По механизму протекания коррозия делится на химическую и электрохимическую.
Химическая коррозия – это разрушение металлов в агрессивных токонепроводящих средах. Она проявляется в виде прямого гетерогенного (межфазного) взаимодействия металла с окислителем окружающей среды. Химическая коррозия бывает:
а) газовая – коррозия в газах и парах без конденсации влаги на поверхности металла,
4 Fe + 3 O2 ® 2 Fe2O3
б) коррозия в неэлектролитах – агрессивных органических жидкостях. Например, коррозия в сернистой нефти:
Fe + S ® FeS
Электрохимическая коррозия характерна для сред с ионной проводимостью. При контакте двух металлов во влажном воздухе возникают микрогальванические пары, приводящие к анодному растворению металла и катодному восстановлению окислителя. Электрохимическая коррозия бывает электролитной, атмосферной, почвенной. Чаще всего электрохимической коррозии подвергаются металлические контакты, сплавы металлов, а также металлы низкой степени чистоты, содержащие металлические или неметаллические примеси.
В процессе электрохимической коррозии более активный металл, имеющий более отрицательное значение стандартного электродного потенциала, отдает электроны и переходит в раствор (служит анодом). Электроны от него перемещаются к менее активному металлу или неметаллической примеси (катоду) и участвуют в восстановительных процессах ионов и молекул, находящихся в окружающей микрогальваническую пару среде.
В кислых растворах идет процесс водородной деполяризации: 2Н+ + 2е  Н2
Н2 
Электрохимический потенциал этой системы определяется величиной рН раствора и парциальным давлением водорода:
j1 = – 0,059 рН – 0,0295 lg(р Н2)
В нейтральных и щелочных средах идет процесс с участием растворенного кислорода воздуха - кислородная деполяризация: О2 + 2Н2О + 4е  4ОН
4ОН 
В этом случае электрохимический потенциал определяется величиной рН раствора и парциальным давлением кислорода:
j2 = 1,23 + 0,01471 lg(р О2) – 0,059 рН
 Пример Коррозия контакта Cu / Zn , среда - КОН.
Пример Коррозия контакта Cu / Zn , среда - КОН.
Zn: Zn - 2e  Zn2+
Zn2+  2
2
Cu: О2 + 2Н2О + 4е  4ОН
4ОН 
 1
1
 Zn + O2 + 2H2O
Zn + O2 + 2H2O 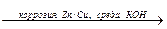 2Zn(OH)2
2Zn(OH)2
Следует отметить, что коррозия по вышеуказанному механизму возможна только при условии, что потенциал окислителя больше потенциала металла (jок > jМ).
Если j1 < jM < j2, то коррозия возможна в щелочной среде и не возможна в кислой. Если jM < j1, то коррозия возможна в любой среде.
Защита от коррозии
Методы защиты от коррозии условно делятся на следующие группы: а) легирование металлов; б) защитные покрытия (металлические и неметаллические); в) электро-химическая защита; г) изменение свойств коррозионной среды; д) рациональное конструирование изделий.
Легирование металлов – это введение в состав сплава компонентов, вызывающих пассивацию металлов. В качестве таких компонентов применяют хром, никель, вольфрам и др.
Защитные покрытия – это слои, искусственно создаваемые на поверхности металлических изделий для предохранения их от коррозии. Защитные покрытия бывают как органические (лаки, краски), так и неорганические (покрытие металлов слоем оксида – оксидирование или воронение – или фосфата – фосфатирования).
Наиболее распространены металлические покрытия, материалами для которых могут быть как чистые металлы (Zn, Al, Cu, Ni, Cr, Ag, Au и др.), так и их сплавы (бронза, латунь и др.). по характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные.
К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительные значения, чем потенциал основного металла (покрытие менее активным металлом). Примерами катодных покрытий могут служить золочение, серебрение металлов, никелирование и лужение (покрытие оловом) стали. Катодные покрытия сами по себе корродируют медленнее, чем металл изделия, однако при повреждении покрытия возникает микрогальванический элемент, в котором основной материал служит анодом и растворяется, а металл покрытия – катодом, на котором выделяется водород или поглощается кислород. Таким образом, катодные покрытия могут защищать металл только при отсутствии повреждений покрытия.
Анодное покрытие – это покрытие металла слоем более активного металла (металлом с более отрицательным потенциалом), например, оцинкованное железо. Более активный металл сам по себе подвергается коррозии, поэтому анодное покрытие менее долговечно. Однако при нарушении целостности покрытия основной металл будет катодом микрогальванического элемента, поэтому коррозия основного металла не происходит до тех пор, пока не растворится покрытие.
Потенциалы металлов зависят от состава растворов, поэтому при изменении условий может изменять характер покрытия. Например, покрытие стали оловом в растворах сильных минеральных кислот – катодное, а в растворах органических кислот – анодное.
Электрохимическая защита металлов от коррозии основана на торможении анодных или катодных реакций коррозионного процесса. Она включает в себя катодную и протекторную защиту. Катодная поляризация осуществляется за счет извне приложенного тока (подключение изделия к отрицательно заряженному электроду). Отрицательный заряд, подаваемый на изделие, препятствует выходу положительно заряженных ионов металла в окружающую среду при коррозионном растворении. Недостатком данного метода защиты является то, что она может применяться только к изделиям, не контактирующими с людьми (шлюзовые ворота, морские трубопроводы, оборудование химических производств).
Защита от коррозии подземных трубопроводов и кабелей осуществляется присоединением к защищаемой конструкции более активного металла (протекторная защита), который служит анодом, то есть разрушается в процессе коррозии, предохраняя при этом изделие.
Разработана также защита металла от коррозии наложением анодной поляризации. Этот метод применим лишь к металлам и сплавам, способным легко пассивироваться при смещении потенциала в положительную сторону (например, предотвращение коррозии нержавеющих сталей в серной кислоте).
Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении (например, деаэрация, то есть удаление кислорода, снижение концентрации ионов водорода и др.). Для защиты от коррозии широко применяют ингибиторы.
Ингибиторы – это вещества, которые уменьшают скорость коррозии металла. По составу различают ингибиторы органические и неорганические. По условиям, в которых они применяются, их можно разделить на ингибиторы для растворов и летучие ингибиторы, которые защищают металлы в условиях атмосферной коррозии.
Механизм действия ингибиторов заключается в их адсорбции на поверхности изделия и торможении катодных или анодных процессов. К анодным ингибиторам можно отнести ингибиторы окисляющего действия (NaNO2, Na2Cr2O7 и др.). К катодным ингибиторам относятся относятся органические вещества, содержащие азот, серу и кислород, например, диэтиламин, уротропин, формальдегид и др. В качестве летучих ингибиторов обычно используются амины с небольшой молярной массой, в которые вводятся группы NO2 или COO-.
ПРОГРАММА
Дата добавления: 2016-11-22; просмотров: 1111;
