Электронное строение металлов
Малое число электронов на последнем уровне и их слабая связь с ядром приводит к возникновению в кристалле металла особого типа химической связи – металлической связи. Валентные электроны каждого атома имеют небольшую энергию ионизации и свободно перемещаются по доступным орбиталям всех соседних атомов, обеспечивая связь между ними, т.е. являются нелокализованными.
Для описания металлической связи часто используют модель «свободного электрона», согласно которой в узлах кристаллической решетки металла находятся положительно заряженные ионы металла, «погруженные» в электронный газ из нелокализованных валентных электронов атомов, участвующих в образовании кристалла. Устойчивость кристалла обеспечивается силами притяжения между положительными ионами и электронным газом.
Различие свойств металлов (проводников), изоляторов и полупроводников можно объяснить с точки зрения метода молекулярных орбиталей – зонной теорией строения кристаллов. В процессе образования кристалла происходит перекрывание валентных электронных орбиталей атомов по аналогии с образованием химической связи в молекулах. При одновременном взаимодействии N валентных атомных орбиталей образуется N молекулярных орбиталей. Величина N в кристаллах может достигать огромных значений (порядка 1023). Поэтому и число электронных орбиталей в твердом теле велико, а разность энергии между отдельными орбиталями ничтожно мала. Таким образом, в кристалле металла образуется энергетическая зона с почти непрерывным распределением энергии (зона проводимости). Заполнение электронами орбиталей зоны проводимости происходит в соответствии с принципом минимума энергии и принципом Паули (на каждой орбитали располагается не более двух электронов). Так как валентных электронов в металлах мало, то зона проводимости заполнена не полностью. При повышении температуры или при наложении электрического поля электроны будут перемещаться на более высокие энергетические уровни, передавая тепловую или электрическую энергию с одного конца кристалла на другой и обеспечивая тепло- и электропроводность металлов.
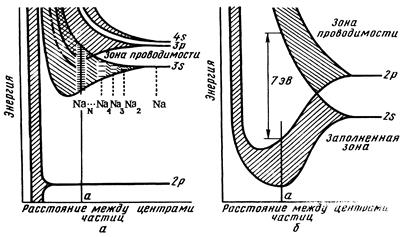
Рис. 1. Возникновение энергетических зон кристалла из энергетических уровней атомов по мере их сближения: а) натрий; б) алмаз
У атомов элементов, образующих кристаллы с ковалентным типом связей (изоляторов и полупроводников) в валентном слое находятся четыре орбитали: одна s- и три р-. При образовании кристалла из N атомов эти орбитали расщепляются, образуя две энергетические зоны по 2N орбиталей в каждой, как это показано на рисунке для кристалла алмаза. Из условий минимума энергии валентные электроны заполняют нижнюю зону (валентную зону), а зона проводимости пустая. Между валентной зоной и зоной проводимости существует запрещенная зона, нахождение электронов на которой невозможно. Если ширина запрещенной зоны относительно невелика, то при сообщении твердому телу определенного количества энергии часть его электронов может перейти из валентной зоны в зону проводимости и принять участие в переносе тока. Подобные вещества называют полупроводниками. Если энергия запрещенной зоны превышает энергию связи в кристалле, соединения называются изоляторами.
Дата добавления: 2016-11-22; просмотров: 1386;
