Примеры решения задач
Пример 29. Выведите формулу зависимости произведения растворимости Ksp от растворимости S для Ag2S.
Решение. Ag2S  2 Ag + + S2 -
2 Ag + + S2 -
Согласно уравнению диссоциации соли,
[Ag +] = 2S (моль/л), [S2 -] = S (моль/л).
Ksp = (2S)2 (S) = 4S3, или
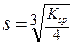
Пример 30. Вычислите растворимость AgCl в присутствии 0.01 M раствора HCl.
Решение. AgCl  Ag+ + Cl-
Ag+ + Cl-
s s (s+0.01 моль/л » 0.01 моль/л)
KSp (AgCl) = [Ag+]×[Cl-] = s × 0.01 = 1,6×10-10, s = 1,6×10-8 моль/л
Пример 31. Выпадет ли осадок PbCl2 при смешивании равных объемов 0.01M раствора Pb(NO3)2 и 0.02M раствора of HCl?
Решение. Pb(NO3)2 + 2HCl ® PbCl2 + 2HNO3
Pb 2+ + 2Cl - ® PbCl2
При смешивании равных объемов рстворов концентрации реагирующих веществ уменьшаются в 2 раза. Концентрации ионов в растворе составляют:
[Pb2+] = C(Pb(NO3)2) = 0.01 / 2 = 0.005 моль/л
[Cl-] = C(HCl) = 0.02 / 2 = 0.01 моль/л
Произведение концентраций ионов в растворе:
Pi = [Pb2+]×[Cl-]2 = 0.005 ´ (0.01)2 = 5×10-7
Из таблицы находим, что KSp(PbCl2) = 1.6×10-5.
Так как Pi < Ksp, то осадок PbCl2 не образуется.
ГИДРОЛИЗ СОЛЕЙ
Если растворенная в воде соль содержит ионы-остатки слабых кислот или слабых оснований, то происходит процесс гидролиза соли - обменной реакции ионов соли с молекулами воды, приводящей к образованию молекул и ионов новых слабых электролитов.
Основные правила написания реакций гидролиза:
1. Гидролизу подвергаются анионы слабых кислот и катионы слабых оснований, входящих в состав соли.
2. Гидролиз - процесс ступенчатый. На каждой ступени один гидролизующийся ион реагирует с одной молекулой воды.
3. В обычных условиях гидролиз протекает только по первой ступени. Гидролиз усиливается при нагревании и разбавлении растворов солей.
4. Гидролиз - процесс, как правило, обратимый, его равновесие можно смещать. Добавление одноименных ионов (Н+ или ОН  ), выделяющихся в процессе гидролиза, смещает равновесие в сторону уменьшения гидролиза. Добавление противоположных ионов, связывающих выделяющиеся ионы Н+ и ОН
), выделяющихся в процессе гидролиза, смещает равновесие в сторону уменьшения гидролиза. Добавление противоположных ионов, связывающих выделяющиеся ионы Н+ и ОН  в молекулы воды, смещает равновесие в сторону усиления гидролиза.
в молекулы воды, смещает равновесие в сторону усиления гидролиза.
Дата добавления: 2016-11-22; просмотров: 2311;
